Management NÚ*
Léčba check point inhibitory – protilátkami anti-PD-(L)1 – u onkologických onemocnění vede k často trvalému klinickému benefitu pro pacienty. Tato léčba je spojena s výskytem nežádoucích účinků souvisejících s mechanismem účinku check point inhibitorů, nazýváme je imunitně podmíněné nežádoucí účinky (irAEs) a mají odlišné spektrum ve srovnání s cytotoxickou chemoterapií. Nežádoucí účinky se obvykle vyskytují během léčby check point inhibitory, mohou se vyskytnout ale i po ukončení léčby.
V managementu imunitně podmíněných nežádoucích účinků je důležitý screening a vyšetření pacientů s cílem včasně identifikovat imunitně podmíněné nežádoucí účinky, správně klasifikovat jejich závažnost a zahájit vhodnou léčbu. Léčba podle typu a závažnosti nežádoucích účinků zahrnuje rozhodnutí, zda v léčbě check point inhibitory pokračovat nebo léčbu přerušit či ukončit, zda iniciovat léčbu podpůrnou a substituční, a zda a v jaké dávce iniciovat léčbu kortikosteroidy. Při managementu imunitně podmíněných nežádoucích účinků je důležitá spolupráce mezi jednotlivými specializacemi, a to zvláště při řešení nežádoucích účinků rezistentních na léčbu kortikosteroidy. Neméně významnou je individuální edukace pacientů o možném výskytu nežádoucích účinků.
* NÚ – nežádoucí účinky
Medián doby do nástupu: 3,3 měsíců (rozmezí 2 dny až 19,3 měsíců).
Medián doby trvání: 1,5 měsíců (rozmezí: 1 den až 17,2+ měsíců).
Řešení nežádoucích reakcí během léčby léčivým přípravkem Keytruda
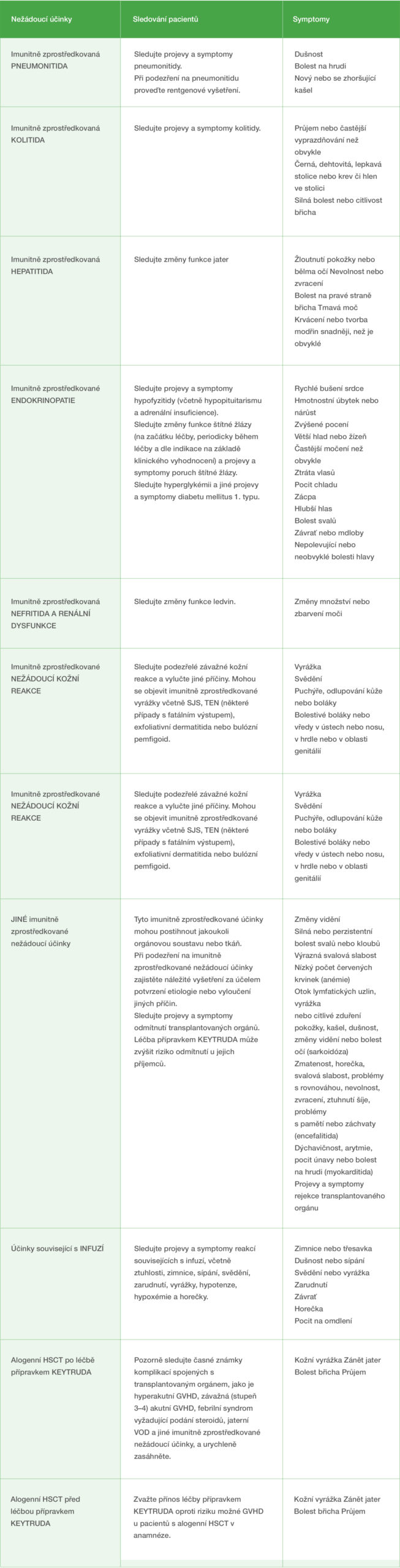
V případě podezření na imunitně zprostředkované nežádoucí účinky zajistěte náležité vyšetření za účelem potvrzení etiologie nebo vyloučení jiných příčin. V závislosti na závažnosti nežádoucího účinku dočasně nebo trvale vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy dle níže uvedených doporučení.1
PNEUMOTITIDA
Stupeň 2
Dočasně vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy
(počáteční dávka 1–2 mg/kg/den prednisonu nebo ekvivalentu s následným postupným vysazováním)
Stupeň 3 nebo 4 nebo rekurentní stupeň 2
Natrvalo vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy (viz dávkování prednisonu výše).
KOLITIDA
Stupeň 2 nebo 3
Dočasně vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy
(počáteční dávka 1–2 mg/kg/den prednisonu nebo ekvivalentu s následným postupným snižováním dávky).
Stupeň 4
Natrvalo vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy (viz dávkování prednisonu výše).
Medián doby do nástupu: 3,5 měsíců (rozmezí 10 dnů až 16,2 měsíců).
Medián doby trvání: 1,3 měsíců (rozmezí: 1 den až 8,7+ měsíců).
HEPATITIDA
U pacientů s HCC
Dočasně vysaďte přípravek KEYTRUDA v následujících případech
- AST nebo ALT ≥ 5násobku horního limitu ULN, byla-li výchozí hodnota nižší než 2násobek ULN; – AST nebo ALT > 3násobek výchozí hodnoty, byla-li výchozí hodnota ≥ 2násobku ULN;
- celkový bilirubin je vyšší než 2,0 mg/dl, byla-li výchozí hodnota nižší než 1,5 mg/dl; nebo
- celkový bilirubin je vyšší než 3,0 mg/dl bez ohledu na výchozí hodnoty.
Obnovte podávání u pacientů s HCC, jakmile se AST nebo ALT a celkový bilirubin vrátí na úroveň 0–1 nebo na výchozí hodnotu.
Přípravek KEYTRUDA natrvalo vysaďte v následujících případech
- ALT nebo AST je vyšší než 10násobek ULN; Childova-Pughova klasifikace je vyšší nebo rovna 9 bodům; – gastrointestinální krvácení naznačuje portální hypertenzi; nebo
- nový vznik klinicky detekovatelných ascitů; nebo encefalopatie.
U pacientů bez HCC
Hepatitida stupně 2
Dočasně vysaďte tento přípravek a podávejte kortikosteroidy (počáteční dávka 0,5–1 mg/kg/den prednisonu nebo ekvivalentu s následným postupným vysazováním).
- Po zlepšení na stupeň 1 nebo nižší začněte snižovat dávku kortikosteroidů a pokračujte v jejím postupném snižování po dobu alespoň 1 měsíce.a
- Znovu nasaďte přípravek KEYTRUDA, pokud imunitně zprostředkovaný nežádoucí účinek zůstane po snižování dávek kortikosteroidů na stupni 1 nebo nižším.
Hepatitida stupně 3 nebo vyšší
Natrvalo vysaďte tento přípravek a podávejte kortikosteroidy (1–2 mg/kg/den prednisonu nebo ekvivalentu s následným postupným vysazováním).
Přípravek KEYTRUDA natrvalo vysaďte v následujících případech
- U pacientů s metastázami v játrech, AST nebo ALT vyšším než 5násobek ULN nebo celkovým bilirubinem vyšším než 3násobek ULN.
- U pacientů s metastázami v játrech a stupněm 2 AST nebo ALT ve výchozím stavu, u nichž došlo ke zvýšení AST nebo ALT o 50 % nebo více oproti výchozí hodnotě a toto zvýšení přetrvává minimálně po dobu 1 týdne.
U pacientů s RCC léčených přípravkem KEYTRUDA v kombinaci s axitinibem
- Je-li ALT nebo AST ≥ 3násobku ULN, ale < 10násobek ULN, aniž by byl zároveň celkový bilirubin ≥ 2násobku ULN, dočasně vysaďte oba přípravky KEYTRUDA i axitinib, dokud se tyto nežádoucí účinky nevrátí na úroveň 0 –1. Zvažte léčbu kortikosteroidy. Zvažte opětovné nasazení jednoho z těchto přípravků nebo postupné nasazení obou přípravků poté, co dojde k návratu na danou úroveň. Pokud znovu nasazujete axitinib, zvažte snížení dávky podle informací pro předepisování axitinibu.
- Je-li ALT nebo AST ≥ 10násobku ULN nebo > 3násobek ULN a zároveň je celkový bilirubin ≥ 2násobku ULN, natrvalo vysaďte oba přípravky KEYTRUDA i axitinib a zvažte léčbu kortikosteroidy
Medián doby do nástupu: 1,3 měsíců (rozmezí 8 dnů až 21,4 měsíců).
Medián doby trvání: 1,8 měsíců (rozmezí: 8 dnů až 20,9+ měsíců).
HYPOFYZITIDA
Stupeň 2
Dočasně vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy a hormonální substituci dle klinické indikace.
Stupeň 3 nebo 4
Dočasně nebo natrvalo vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy a hormonální substituci dle klinické indikace.
Medián doby do nástupu: 3,7 měsíců (rozmezí 1 den až 11,9 měsíců).
Medián doby trvání: 4,7 měsíců (rozmezí: 8+ dnů až 12,7+ měsíců).
HYPERTYREÓZA
Všechny stupně
Podávejte podle potřeby thionamidy a betablokátory.
Stupeň 3 nebo 4
Dočasně nebo natrvalo vysaďte přípravek KEYTRUDA.
Medián doby do nástupu: 1,4 měsíců (rozmezí 1 den až 21,9 měsíců).
Medián doby trvání: 2,1 měsíců (rozmezí: 3 dny až 15,0+ měsíců).
HYPOTYREÓZA
Podávejte hormonální substituci.
Medián doby do nástupu: 3,5 měsíců (rozmezí 1 den až 18,9 měsíců).
Medián doby trvání: nedosažen (rozmezí: 2 dny až 27,7+ měsíců).
DIABETES 1. TYPU
U diabetu 1. typu podávejte inzulín, u pacientů s těžkou hyperglykémií dočasně vysaďte přípravek KEYTRUDA a podávejte antihyperglykemické přípravky.
NEFRITIDA
Stupeň 2
Dočasně vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy. (počáteční dávka 1–2 mg/kg/den prednisonu nebo ekvivalentu s následným postupným vysazováním).
Stupeň 3 nebo 4
Natrvalo vysaďte přípravek KEYTRUDA a podávejte kortikosteroidy (viz výše uvedené dávkování prednisonu).
Medián doby do nástupu: 5,1 měsíců (rozmezí 12 dnů až 12,8 měsíců).
Medián doby trvání: 3,3 měsíců (rozmezí: 12 dnů až 8,9+ měsíců).
KOŽNÍ REAKCE
Imunitně zprostředkované vyrážky včetně exfoliativní dermatitidy a bulózního pemfigoidu: v závislosti na závažnosti nežádoucího účinku vysaďte přípravek KEYTRUDA dočasně nebo natrvalo a podávejte kortikosteroidy.
Podezření na SJS nebo TEN: dočasně vysaďte přípravek KEYTRUDA a odkažte pacienta do péče specialisty, který vyhodnotí jeho stav a zajistí léčbu.
Potvrzený SJS nebo TEN: vysaďte přípravek KEYTRUDA natrvalo.
ÚČINKY SOUVISEJÍCÍ S INFUZÍ
Stupeň 3 nebo 4
Ukončete infuzi a vysaďte přípravek KEYTRUDA natrvalo.
ALOGENNÍ HSCT PO LÉČBĚ PŘÍPRAVKEM KEYTRUDA
Pozorně sledujte časné známky komplikací spojených s transplantovaným orgánem, jako je hyperakutní GVHD, závažná (stupeň 3–4) akutní GVHD, febrilní syndrom vyžadující podání steroidů, jaterní VOD a jiné imunitně zprostředkované nežádoucí účinky, a urychleně zasáhněte.
ALOGENNÍ HSCT PŘED LÉČBOU PŘÍPRAVKEM KEYTRUDA
Zvažte přínos léčby přípravkem KEYTRUDA oproti riziku možné GVHD u pacientů s alogenní HSCT v anamnéze. Upozorněte pacienty na riziko komplikací po alogenní HSCT.
HEMATOLOGICKÁ TOXICITA U PACIENTŮ S cHL
Stupeň 4
Dočasně vysaďte přípravek KEYTRUDA do návratu na stupeň 0 nebo 1.
Následná opatření
Znovu nasaďte přípravek Keytruda, pokud nežádoucí účinky se ustálí na stupni 1 nebo nižším po podávání kortikosteroidů s jejich postupným vysazováním po dobu minimálně 1 měsíce.

Přípravek keytruda natrvalo vysaďte, pokud
- nastane jakýkoli život ohrožující nežádoucí účinek,
- perzistentní nežádoucí účinek stupně 2 nebo 3 (vyjma endokrinopatií kontrolovaných hormonální substituční terapií) se nezlepší na stupeň 0–1 do 12 týdnů od poslední dávky přípravku KEYTRUDA,
- denní dávku kortikosteroidů není možno snížit na 10 mg nebo méně prednisonu nebo ekvivalentu do 12 týdnů,
- nastane jakýkoli nežádoucí účinek stupně 3 (závažný), který souvisí s léčbou nebo je imunitně zprostředkovaný.

Imunitně zprostředkované nežádoucí účinky hlášené při podávání přípravku KEYTRUDA
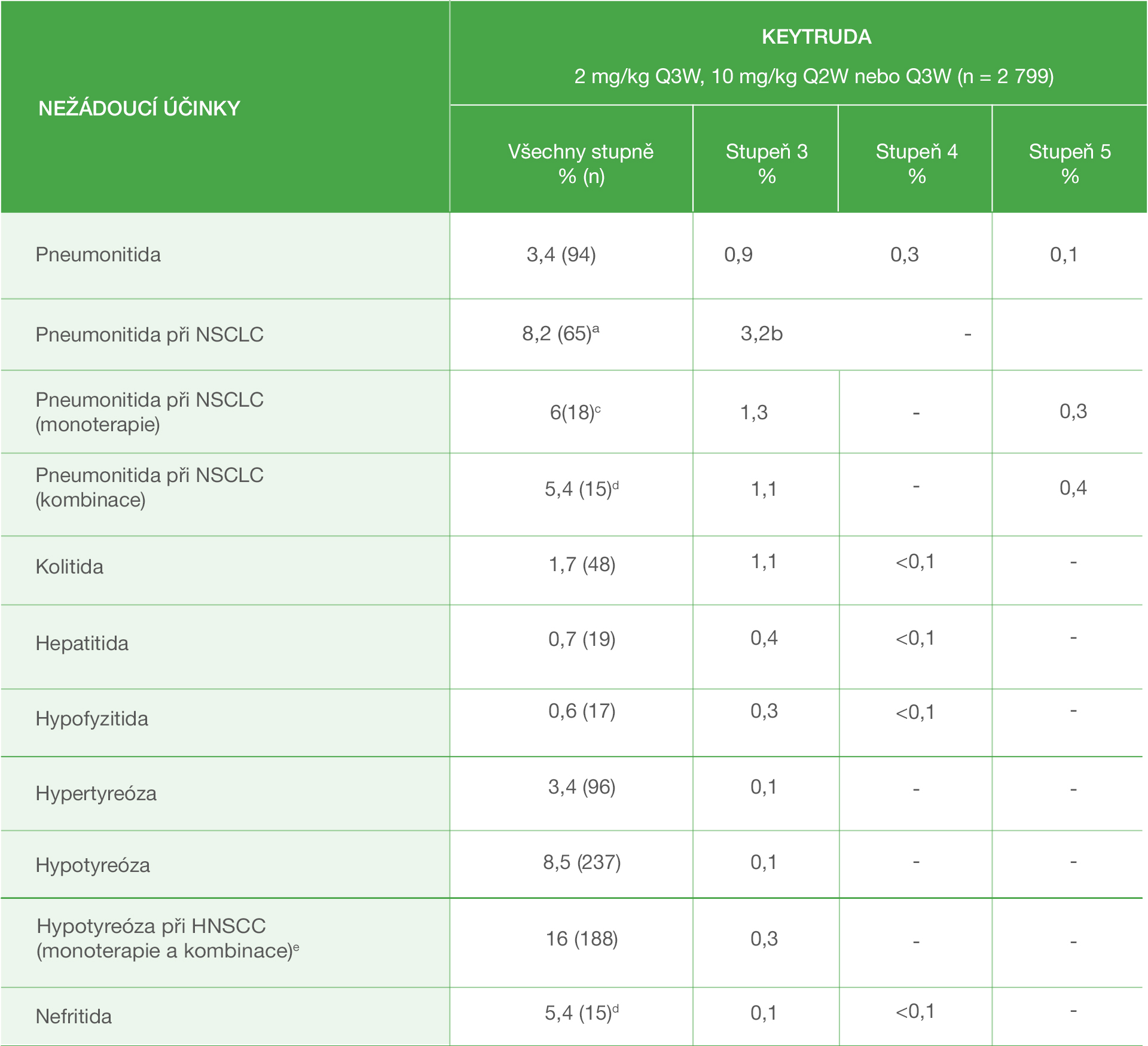
- Z 2 799 pacientů léčených přípravkem KEYTRUDA byl u 6 (0,2 %) pacientů hlášen imunitně zprostředkovaný diabetes mellitus 1. typu, včetně diabetické ketoacidózy, a u 16 (0,6 %) pacientů se objevila tyroiditida.
- Pneumonitida se vyskytla u 17 % ze 790 pacientů s NSCLC, kteří předtím podstoupili ozařování hrudníku, oproti 7,7 % pacientů, kteří ho nepodstoupili.
- Nefritida se vyskytla u 1,7 % (7/405) pacientů léčených přípravkem KEYTRUDA v kombinaci s chemoterapií pomocí přípravků pemetrexed a platina.
- KEYTRUDA v kombinaci s axitinibem může způsobit hepatální toxicitu s vyšší než předpokládanou četností se zvýšením hladin ALT a AST stupně 3 a 4 v porovnání s podáváním samotného přípravku KEYTRUDA. Zvýšené hladiny ALT stupně 3 a 4 byly zjištěny u 20 % pacientů, zvýšené hladiny AST stupně 3 a 4 pak u 13 % pacientů. Sledujte hodnoty jaterních enzymů před nasazením přípravků a poté periodicky po celou dobu léčby. Zvažte častější monitorování jaterních enzymů, než jaké by bylo použito v případě užívání těchto léků v monoterapii. V případě zvýšených hodnot jaterních enzymů přerušte podávání přípravků KEYTRUDA a axitinib a zvažte podávání kortikosteroidů dle potřeby.
- Mohou se objevit imunitně zprostředkované vyrážky, včetně SJS, TEN (některé případy s fatálními následky), exfoliativní dermatitidy a bulózního pemfigoidu. Sledujte pacienty v případě podezření na výrazné kožní reakce a v závislosti na závažnosti nežádoucího účinku vysaďte přípravek KEYTRUDA dočasně nebo natrvalo a podávejte kortikosteroidy. V případě projevů nebo symptomů SJS nebo TEN dočasně vysaďte přípravek KEYTRUDA a odkažte pacienta do péče specialisty, který vyhodnotí jeho stav a zajistí léčbu. V případě potvrzení SJS nebo TEN vysaďte přípravek KEYTRUDA natrvalo.
- V případě podezření na imunitně zprostředkované nežádoucí účinky zajistěte náležité vyšetření za účelem potvrzení etiologie nebo vyloučení jiných příčin. V závislosti na závažnosti nežádoucího účinku vysaďte přípravek KEYTRUDA dočasně nebo natrvalo a podávejte kortikosteroidy.
- Následující klinicky významné imunitně zprostředkované nežádoucí účinky byly zaznamenány u méně než 1 % (není-li uvedeno jinak) z 2 799 pacientů léčených přípravkem KEYTRUDA: artritida (1,5 %), uveitida, myositida, Guillainův-Barrého syndrom, myasténie gravis, vaskulitida, pankreatitida, hemolytická anémie, sarkoidóza a encefalitida. V dalších klinických studiích, které zahrnovaly také klasický Hodgkinův lymfom, a z praxe po uvedení přípravku na trh byly navíc hlášeny myelitida a myokarditida.
- U pacientů léčených přípravkem KEYTRUDA jsou v době po uvedení přípravku na trh hlášeny případy rejekce transplantovaného orgánu.
- Těžké nebo život ohrožující účinky spojené s infuzí byly nahlášeny u 6 (0,2 %) z 2 799 pacientů léčených přípravkem KEYTRUDA.
- Imunitně zprostředkované komplikace, včetně fatálních případů, nastaly u pacientů, kteří po léčbě přípravkem KEYTRUDA podstoupili alogenní HSCT. Z 23 pacientů s cHL, kteří po léčbě přípravkem KEYTRUDA podstoupili alogenní HSCT, došlo u 6 pacientů (26 %) k GVHD (1 fatální případ) a u 2 pacientů (9 %) k vážné jaterní VOD po režimu s nižší intenzitou (1 fatální případ). Případy fatální hyperakutní GVHD po alogenní HSCT byly také hlášeny u pacientů s lymfomem, kteří před transplantací dostali protilátku blokující receptor PD-1. Pozorně sledujte, zda se u pacientů neobjeví časné známky komplikací spojených s transplantací orgánu, jako je hyperakutní GVHD, závažná (stupeň 3–4) akutní GVHD, febrilní syndrom vyžadující podání steroidů, jaterní VOD a jiné imunitně zprostředkované nežádoucí účinky.
- U pacientů s alogenní HSCT v anamnéze byly hlášeny případy akutní GVHD, včetně fatální GVHD, po léčbě přípravkem KEYTRUDA. U pacientů, u kterých po transplantaci došlo k GVHD, může po podávání přípravku KEYTRUDA existovat zvýšené riziko GVHD. Zvažte přínos léčby přípravkem KEYTRUDA oproti riziku možné GVHD u těchto pacientů.
Reference:
- National Cancer Institute. Common Terminology Criteria for Adverse Events (CTCAE); v5.0. Bethesda, MD: National Cancer Institute 2017.
- American Cancer Society. What is cancer immunotherapy? https://www.cancer.org/treatment/treatments-and-side-effects/treatment-types/immunotherapy/what-is-immunotherapy.html. Updated August 8, 2016. Accessed June 18, 2019.
- Villadolid J, Amin A. Immune checkpoint inhibitors in clinical practice: update on management of immune-related toxicities. Transl Lung Cancer Res. 2015;4(5):560–575.
- Kannan R, Madden K, Andrews S. Primer on immuno-oncology and immune response. Clin J Oncol Nurs. 2014;18(3):311–317, 326.
- Teply BA, Lipson EJ. Identification and management of toxicities from immune checkpoint–blocking drugs. Oncology (Williston Park). 2014;28(suppl 3):30–38.
- American Cancer Society. The doctor-patient relationship. https://www.cancer.org/treatment/understanding-your-diagnosis/talking-about-cancer/the-doctor-patient-relationship.html. Updated May 25, 2016. Accessed June 18, 2019.
- SPC LP Keytruda.
- Myers G. Curr Oncol 2018 Oct;25(5):342-347.