Design klinické studie
Multicentrické, randomizované, otevřené, aktivním komparátorem kontrolované klinické hodnocení fáze 3.1,2
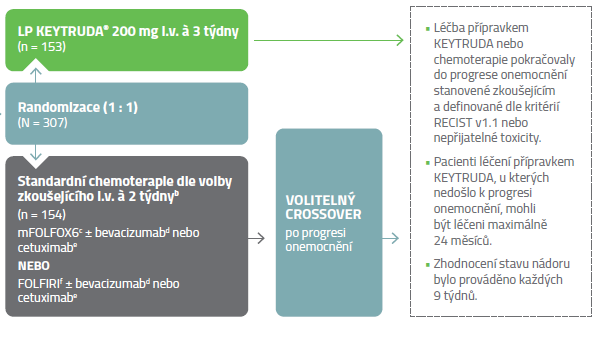
Hlavní vstupní kritéria
- Pacienti s dříve neléčeným metastatickým MSI-H nebo dMMR CRCa.
Hlavní vylučující kritéria
- Pacienti s autoimunitním onemocněním nebo zdravotním stavem vyžadujícím imunosupresi.
Primární cílové parametry účinnosti
- celkové přežití (OS)
- přežití bez progrese (PFS) hodnocené BICR podle kritérií RECIST v 1.1 modifikovaných tak, že bylo povoleno maximálně 10 cílových lézí a maximálně 5 cílových lézí na orgán
Sekundární cílové parametry účinnosti
- míra objektivní odpovědi (ORR)
- trvání odpovědi (DOR)
| Vstupní charakteristiky | Všichni pacienti ( n = 307) |
|---|---|
| Medián věku (rozmezí) | 63 let (24 – 93) |
| Věk 65 let | 47 % |
| Muži | 50 % |
| Rasa etnikum: Běloši Asiaté | 75 % 16 % |
| ECOG PS: 0 1 | 52 % 48 % |
| Chemoterapeutický režim Pacienti na chemoterapii d (n = 143) | |
|---|---|
| 56 % | mFOLFOX6 (leukovorin, 5-FU a oxaliplatina) ± bevacizumab nebo cetuximab |
| 44 % | FOLFIRI (leukovorin, 5-FU a irinotecan) ± bevacizumab nebo cetuximab |
Upraveno podle souhrnu údajů o přípravku KEYTRUDA®.1
a MSI nebo MMR nádorový status byl určen lokálně za pomoci polymerázové řetězové reakce (PCR), nebo imunohistochemicky (IHC).
b Pacientům randomizovaným k chemoterapii byla po progresi onemocnění nabídnuta léčba přípravkem KEYTRUDA®.
c Oxaliplatina 85 mg/m2, leukovorin 400 mg/m2 (nebo levoleukovorin 200 mg/m2) a 5-FU 400 mg/m2 bolus 1. den, následně 5-FU 2400 mg/m2 během 46–48 hodin.
d Bevacizumab 5 mg/kg 1. den. Cetuximab 400 mg/m2 při první infuzi, následně každý týden 250 mg/m2. Irinotekan 180 mg/m2, leukovorin 400 mg/m2 (nebo levoleukovorin 200 mg/m2) a 5-FU 400 mg/m2 bolus 1. den, následně 5-FU 2400 mg/m2 během 46–48 hodin. Ze 154 pacientů randomizovaných do ramene se standardní chemoterapií jich podstoupilo chemoterapii 143.
Reference:
1 SPC přípravku KEYTRUDA® na www.sukl.cz, datum poslední revise 25. 2. 2025.
2 André T et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383(23): 2207–18.
Zkratky:
5-FU = 5-fluorouracil
BICR = zaslepené nezávislé centrální hodnocení
CR = kolorektální karcinom
dMMR = deficit systému opravy chybného párování bází
DOR = trvání odpovědi
ECOG PS = výkonnostní stav dle chybného párování bází
FOLFIRI = leukovorin, 5-FU, irinotekan
mFOLFOX6 = leukovorin, 5-FU, oxaliplatina (modifikovaný režim)
MSI-H = vysoká mikrosatelitová nestabilita
ORR = míra objektivních odpovědí
OS = celkové přežití
PFS = přežití bez progrese
RECIST = kritéria hodnocení odpovědi na léčbu u solidních nádorů