KEYNOTE-671
1L u resekovatelného NSCLC
Přípravek KEYTRUDA® je indikován v kombinaci s chemoterapií obsahující platinu v neoadjuvantní léčbě a následně po chirurgickém výkonu v monoterapii v adjuvantní léčbě resekovatelného NSCLC s vysokým rizikem recidivy u dospělých.1
Design klinické studie1-5
Randomizovaná, dvojitě zaslepená, multicentrická, placebem kontrolovaná studie fáze 3 u pacientů s resekovatelným NSCLC stadia II, IIIA nebo IIIB(N2) bez ohledu na expresi PD-L1.a
Klíčová kritéria pro zařazení
- pacienti s dosud neléčeným a resekovatelným NSCLC stadia II, IIIA nebo IIIB(N2) podle 8. vydání AJCC
- bez ohledu na expresi PD-L1b
- žádná předchozí léčba inhibitory anti-PD-(L)1 nebo anti-PD-L2 ani jinými inhibitory zaměřenými na koinhibiční receptory T-lymfocitů
- pacient schopen podstoupit chirurgický zákrok
- výkonnostní stav dle ECOG 0 nebo 1
Klíčová kritéria pro nezařazení
- aktivní autoimunitní onemocnění vyžadující během posledních 2 let systémovou léčbu
- jiný zdravotní stav vyžadující dlouhodobou imunosupresi
- ILD nebo pneumonitida vyžadující léčbu steroidy
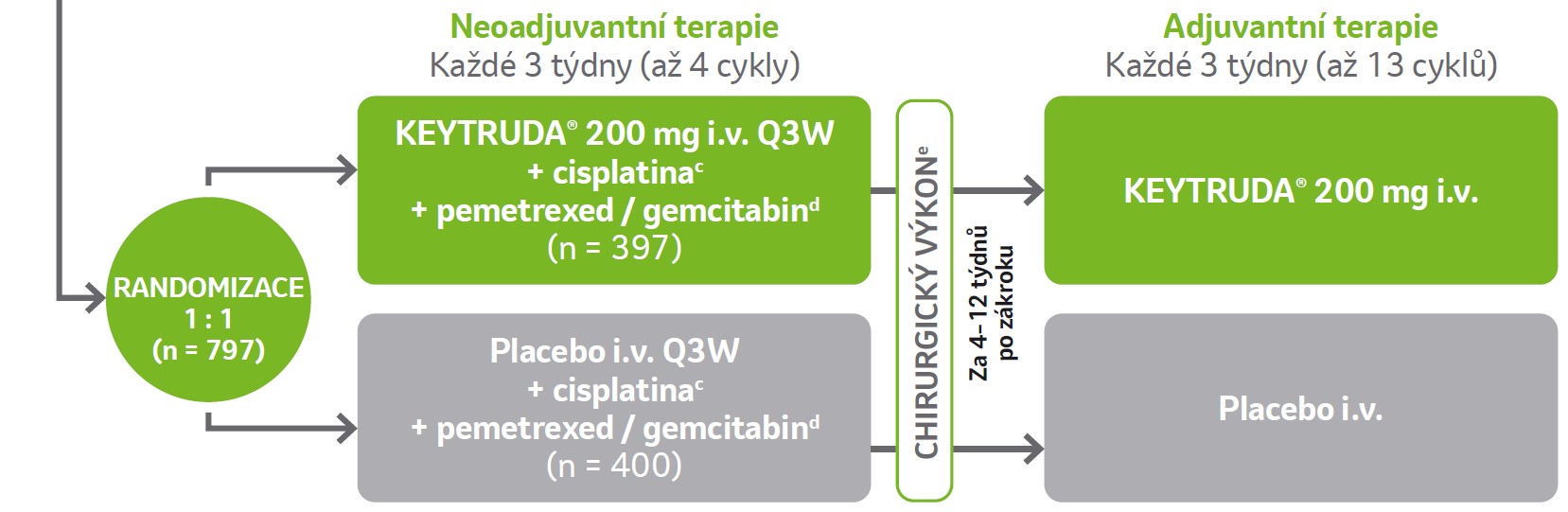
Upraveno podle Wakelee H, et al. (2023).
Duální primární kritéria hodnocení
- celkové přežití (OS)f
- přežití bez příhody (EFS)g
Sekundární kritéria hodnocení
- kompletní patologická odpověď (pCR)h
- major pathological response (MPR)h
- bezpečnost
Stratifi kační faktory
- stadium onemocnění (II vs. III)
- PD-L1 TPSe (<50% vs. ≥50%)
- histologie (skvamózní vs. neskvamózní)
- oblast (východní Asie vs. jiná)
Léčba pokračovala do dosažení maximálního počtu podání, progrese onemocnění, jež vylučovala definitivní chirurgický zákrok, recidivy onemocnění v adjuvantní fázi, progresi onemocnění u pacientů, kteří nepodstoupili chirurgický zákrok nebo u nich byla provedena nekompletní resekce a kteří vstoupili do adjuvantní fáze, do nepřijatelné toxicity, do rozhodnutí zkoušejícího nebo v případě odstoupení pacienta ze studie.
a Definováno American Joint Committee on Cancer (AJCC), 8. vydání.
b Hodnoceno v centrální laboratoři pomocí PD-L1 IHC 22C3 parmDx.
c Cisplatina 75 mg/m2 i.v. každé 3 týdny + gemcitabin 1 000 mg/m2 i.v. 1. a 8. den každé 3 týdny byla povolena pouze pro skvamózní histologii.
d Cisplatina 75 mg/m2 i.v. každé 3 týdny + pemetrexed 500 mg/m2 i.v. každé 3 týdny byla povolena pouze pro neskvamózní histologii.
e Chirurgický zákrok proběhl 20 týdnu po první dávce, resp. 4-8 týdnu po poslední dávce, pokud byly podány <4 neoadjuvantní cykly. Radioterapie po operaci byla podávána u pacientů, u kterých přetrvávalo reziduální onemocnění.
f Definováno jako doba od randomizace do úmrtí z jakékoli příčiny.
g Definováno jako doba od randomizace do prvního výskytu lokální progrese, jež vylučovala plánovaný chirurgický zákrok, do výskytu neresekovatelného nádoru, progrese nebo recidivy podle RECIST v1.1, hodnoceno zkoušejícím, nebo do úmrtí z jakékoli příčiny.
h Hodnoceno zaslepenou nezávislou kontrolou patologem.
Výchozí charakteristiky1-3
Výchozí charakteristiky byly všeobecně dobře vyvážené.
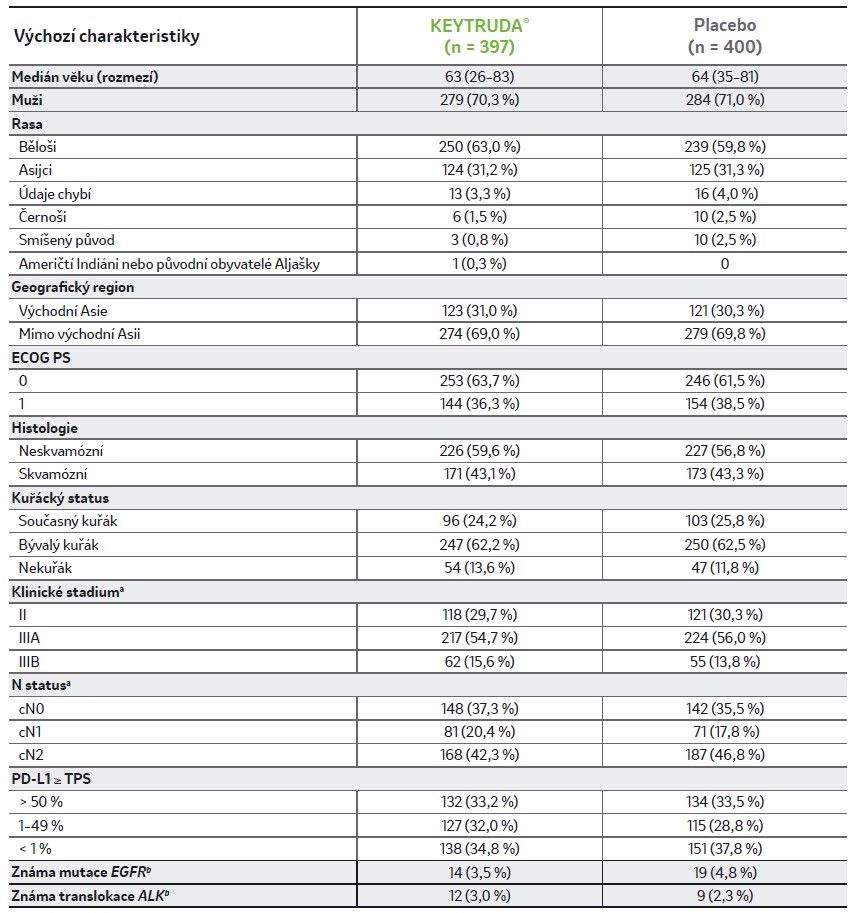
Upraveno podle Wakelee H, et al. (2023) a Spicer J, et al. (2023).
a Dle výsledku zobrazovacích metod a biopsie.
b Mutace EGFR a translokace ALK byly testovány lokálně podle uvážení zkoušejícího. Stav mutace EGFR nebyl znám u 272 (68,5 %) pacientů ve větvi s pembrolizumabem a u 257 (64,3 %) pacientů ve větvi s placebem; stav ALK translokace nebyl znám u 281 (70,8 %) pacientek ve větvi s pembrolizumabem a u 259 (64,8 %) pacientek ve větvi s placebem.
Datum uzávěrky databáze pro IA2: 10. červenec 2023.
1. SPC přípravku KEYTRUDA® na www.sukl.cz.
2. Wakelee H, et al. Perioperative Pembrolizumab for Early-Stage Non-Small Cell Lung Cancer. N Engl J Med. 2023;389(6):491–503.
3. Spicer J, et al. Impact of Surgical Factors on Event-Free Survival in the Randomized, Placebo-Contolled, Phase 3 KEYNOTE-671 Trial of Perioperative Pembrolizumab for
Early-Stage Non-Small-Cell Lung Cancer. Slide deck presented at: The 60th Annual Meeting of The Society of Thoracic Surgeons; January 27-29, 2024. San Antonio, Texas,
United States.
4. Spicer J, et al. Overall Survival in the KEYNOTE-671 Study of Perioperative Pembrolizumab for Early-Stage NSCLC. Slide deck presented at: European Society for Medical
Oncology; October 20–24, 2023; Madrid, Spain. Abstract LBA56.
5. Wakelee H, et al. Perioperative Pembrolizumab for Early-Stage Non-Small Cell Lung Cancer. N Engl J Med. 2023;389(6):491–503. Supplementary appendix.
AE: nežádoucí príhoda; AJCC: American Joint Committee on Cancer; ALK: anaplastická lymfomová kináza; ALT: alaninaminotransferáza; CI: interval spolehlivosti; ECOG PS: výkonnostní stav dle Eastern Cooperative Oncology Group; EFS: prežití bez príhody; EGFR: receptor epidermálního rustového faktoru; EMA: Evropská agentura pro lécivé přípravky; ESMO: European Society for Medical Oncology; HR: poměr rizik; IA: prubežná analýza; IASLC: International Association for the Study of Lung Cancer; IHC: imunohistochemie; ILD: intersticiální plicní nemoc; i.v.: intravenózní; MPR: major pathological response; N: postižení lymfatických uzlin; n: počet; N0: bez zasažení regionálních uzlin; N1: metastázy inspilaterálních peribronchiálních, a/nebo hilových a intrapulmonárních uzlin; N2: metastázy do ipsilaterálních mediastinálních/subkarinálních uzlin; NR: nebylo dosaženo; NSCLC: nemalobuněčný karcinom plic; OS: celkové přežití; pCR: kompletní patologická odpověď; PD-L1: ligand programované bunecné smrti 1; p: patologický; P: hodnota P; PET: pozitronová emisní tomografie; R0: žádné reziduální onemocnení; R1: mikroskopické reziduální onemocnění; R2: makroskopické reziduální onemocnění; RECIST: Response Evaluation Criteria in Solid Tumours; SPC: souhrn údaju o přípravku; T0: žádný primární nádor; Tis: karcinom in situ; TPS: skóre nádorového podílu; y: restaging.