Bezpečnost1
KEYTRUDA® prokázala zvládnutelný profil snášenlivosti bez žádných nových bezpečnostních signálů.1, 2
Shrnutí nežádoucích příhod souvisejících s léčbou u všech léčených pacientů
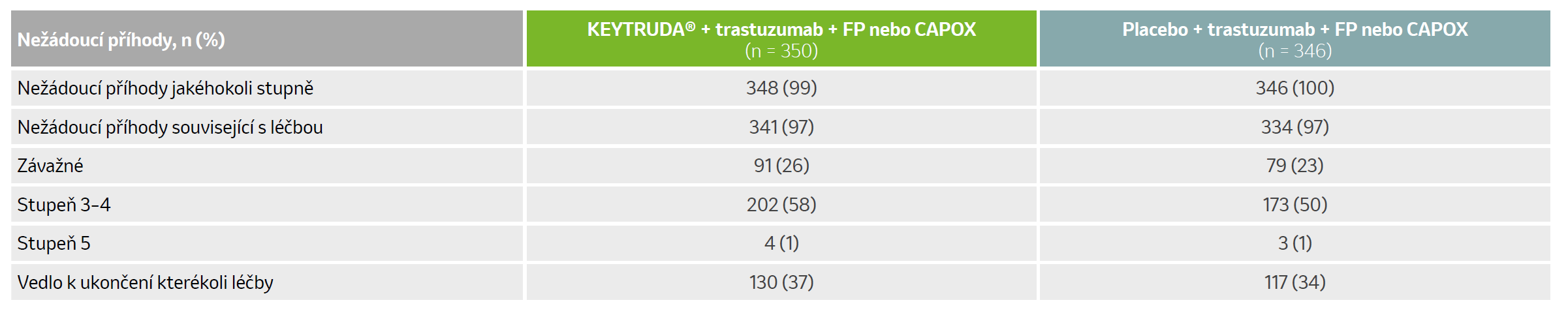
Nežádoucí příhody související s léčbou s incidencí ≥ 10 %

Reference:
1. Janjigian YY, Kawazoe A, Bai Y, et al. Overall Survival From Final Analysis of the Phase 3 KEYNOTE-811 Study Evaluating Pembrolizumab Plus Trastuzumab and Chemotherapy in Unresectable or Metastatic HER2+ Gastric/ GEJ Adenocarcinoma. Slide deck
presented at: ESMO Congress 2024; 14 September 2024; Barcelona, Spain. Abstract 14000.
2. SPC přípravku KEYTRUDA® na www.sukl.cz.
AE: nežádoucí účinek; ALT: alaninaminotransferáza; AST: aspartátaminotransferáza; 5-FU: 5-fluorouracil; BICR: zaslepené nezávislé centrální hodnocení; BID: dvakrát denně; CAPOX: kapecitabin a oxaliplatina; CI: interval spolehlivosti; CPS: kombinované pozitivní skóre; CR: kompletní odpověď; DOR: trvání odpovědi; FP: 5-fluorouracil a cisplatina; GEJ: gastroezofageální junkce; HER2: receptor lidského epidermálního růstového faktoru 2; HR: poměr rizik; IV: intravenózní; IHC: imunohistochemie; ISH: in situ hybridizace; ORR: míra objektivní odpovědi; OS: celkové přežití; PD-L1: ligand receptoru programované buněčné smrti 1; PFS: přežití bez progrese; PPES: syndrom palmoplantární erytrodysestézie; PR: částečná odpověď; Q3W: každé 3 týdny; T1DM: diabetes mellitus 1. typu; RECIST v1.1: kritéria hodnocení odpovědi na léčbu u solidních nádorů verze 1.1