Výsledky ORR, DOR ve finální analýze1
Vyšší přínos v ORR oproti placebu v populaci s expresí PD-L1 s CPS ≥ 1.1
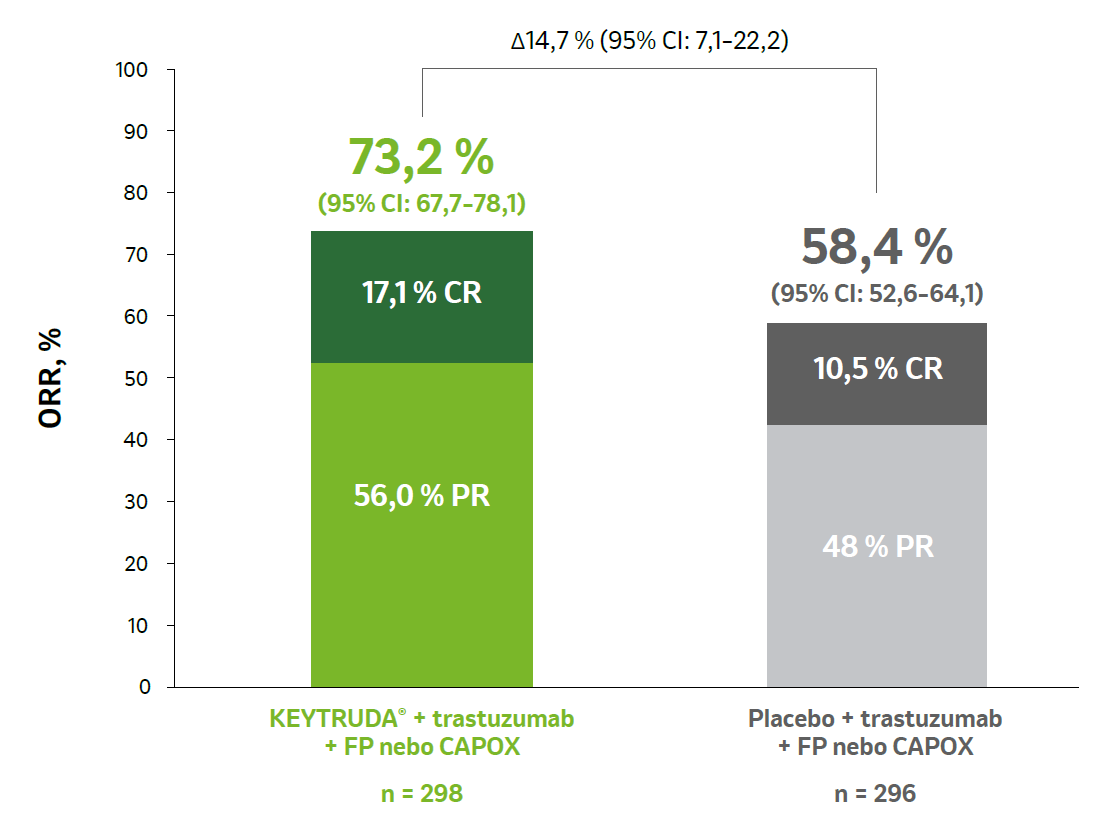

a Odpověď byla hodnocena podle RECIST v1.1 zaslepeným nezávislým centrálním hodnocením. Kvůli zaokrouhlování nemusí být celková procenta = 100.
b Objektivní odpověď byla stanovena jako podíl pacientů s nejlepší odpovědí v podobě úplné nebo částečné odpovědi.
Medián trvání odpovědi u CPS ≥ 1 populace (finální analýza)a, 2
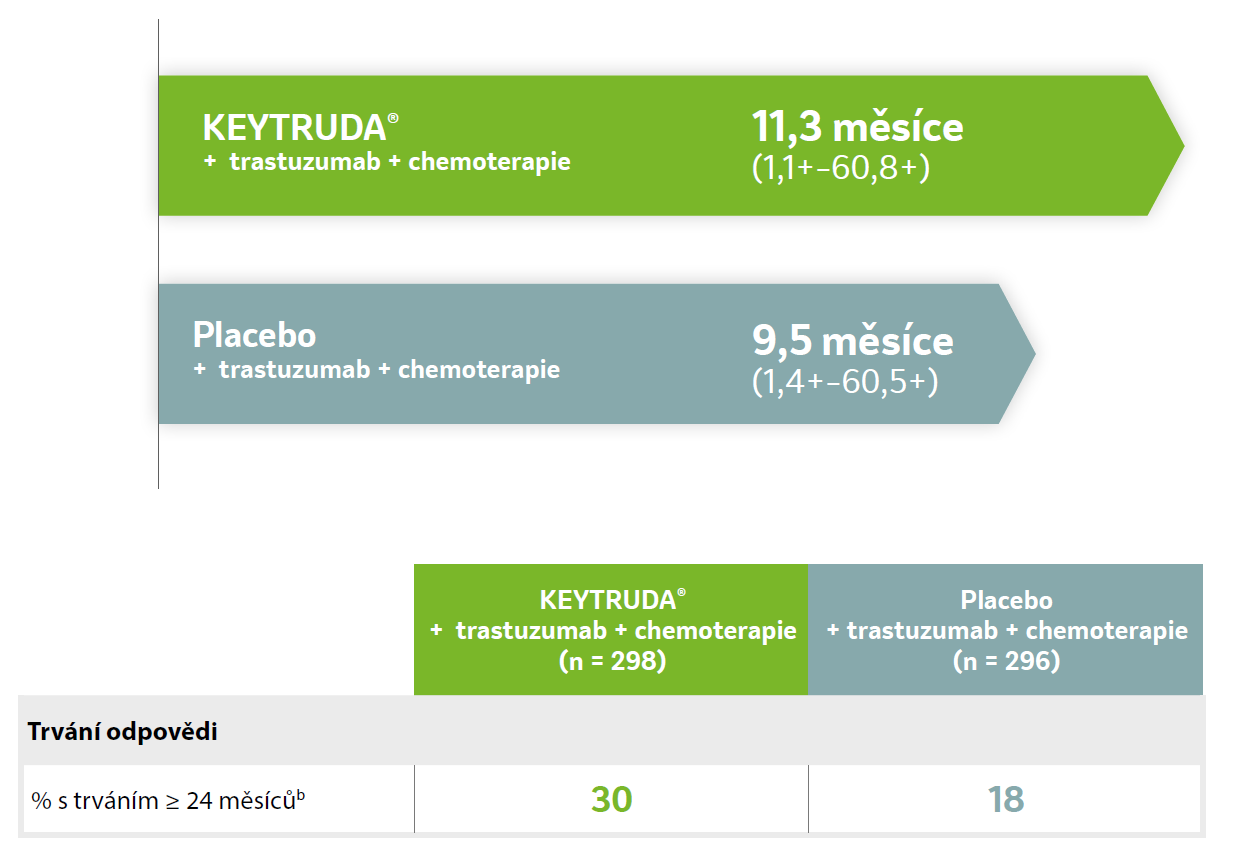
Trvání odpovědi dle léčebného ramene u pacientů ve studii KEYNOTE-811 s expresí PD-L1 (CPS ≥ 1). Upraveno podle Janjigian YY, et al. Lancet. 2023. (Supplementary appendix)
a V době třetí průběžné analýzy (IA3) byl medián sledování ve skupině s přípravkem KEYTRUDA® 38,4 měsíce (IQR 29,5–44,4) a ve skupině s placebem 38,6 měsíce (IQR 30,2–44,4). Ve třetí průběžné analýze (IAR) neproběhlo žádné formální testování hypotézy.
b Na základě Kaplan-Meierova odhadu.
Reference:
1. Janjigian YY, Kawazoe A, Bai Y, et al. Overall Survival From Final Analysis of the Phase 3 KEYNOTE-811 Study Evaluating Pembrolizumab Plus Trastuzumab and Chemotherapy in Unresectable or Metastatic HER2+ Gastric/ GEJ Adenocarcinoma. Slide deck
presented at: ESMO Congress 2024; 14 September 2024; Barcelona, Spain. Abstract 14000.
2. Janjigian YY, et al. Pembrolizumab plus trastuzumab and chemotherapy for HER2-positive gastro-oesophageal junction adenocarcinoma:interim analyses from the phase 3 KEYNOTE-811 randomised placebo-controlled trial. Lancet. 2023;S0140-
6736(23)02033-0.doi: 10.1016/S0140-6736(23)02033-0 [Online ahead of print].
AE: nežádoucí účinek; ALT: alaninaminotransferáza; AST: aspartátaminotransferáza; 5-FU: 5-fluorouracil; BICR: zaslepené nezávislé centrální hodnocení; BID: dvakrát denně; CAPOX: kapecitabin a oxaliplatina; CI: interval spolehlivosti; CPS: kombinované pozitivní skóre; CR: kompletní odpověď; DOR: trvání odpovědi; FP: 5-fluorouracil a cisplatina; GEJ: gastroezofageální junkce; HER2: receptor lidského epidermálního růstového faktoru 2; HR: poměr rizik; IV: intravenózní; IHC: imunohistochemie; ISH: in situ hybridizace; ORR: míra objektivní odpovědi; OS: celkové přežití; PD-L1: ligand receptoru programované buněčné smrti 1; PFS: přežití bez progrese; PPES: syndrom palmoplantární erytrodysestézie; PR: částečná odpověď; Q3W: každé 3 týdny; T1DM: diabetes mellitus 1. typu; RECIST v1.1: kritéria hodnocení odpovědi na léčbu u solidních nádorů verze 1.1