Bezpečnost1
VYBRANÉ NEŽÁDOUCÍ ÚČINKY
Závažné a fatální imunitně zprostředkované nežádoucí účinky
Přípravek KEYTRUDA® je monoklonální protilátka patřící do skupiny léčiv, které se vážou buď na receptor programované buněčné smrti PD-1 (programmed cell death-1) nebo jeho ligand PD-L1 a způsobují tak zablokování signální cesty PD-1/PD-L1. To vede ke zrušení inhibice imunitní odpovědi, což může potenciálně způsobit narušení periferní tolerance a indukovat imunitně zprostředkované nežádoucí účinky. Imunitně zprostředkované nežádoucí účinky, které mohou být závažné nebo fatální, mohou postihnout kterýkoliv orgánový systém nebo tkáň, mohou se vyskytnout ve více orgánových systémech současně a mohou se objevit kdykoliv po zahájení léčby nebo po jejím ukončení. Důležité imunitně zprostředkované nežádoucí účinky, které jsou zde vyjmenovány, nemusí zahrnovat veškeré možné závažné a fatální imunitně zprostředkované nežádoucí účinky.
Pečlivě pacienty sledujte stran výskytu příznaků a známek, které by mohly být klinickou manifestací imunitně zprostředkovaných nežádoucích účinků. Jejich časná identifikace a léčba je pro bezpečné užití léčby cílené na PD-1/PD-L1 zásadní. Před zahájením léčby a pak pravidelně v jejím průběhu mají být sledovány hladiny jaterních enzymů, kreatininu a funkce štítné žlázy. Při podezření na imunitně zprostředkované nežádoucí účinky má být zajištěno odpovídající vyšetření, aby se vyloučily jiné příčiny, včetně infekce. Dle situace může být vyžadováno zahájení okamžité lékařské intervence, včetně konzultace se specialisty.
V závislosti na závažnosti imunitně zprostředkovaného nežádoucího účinku má být přípravek KEYTRUDA® dočasně nebo trvale vysazen. Obecně, pokud je nutné léčbu přípravkem KEYTRUDA® přerušit nebo ji vysadit, mají být podávány systémové kortikosteroidy (1 až 2 mg/kg/den prednisonu nebo jeho ekvivalentu), dokud nedojde ke zlepšení na stupeň 0 nebo 1. Jakmile dojde ke zlepšení nežádoucího účinku na stupeň 0 nebo 1, má být zahájeno postupné vysazování kortikosteroidu trvající minimálně 1 měsíc. U pacientů, jejichž nežádoucí účinky nejsou dostatečně kontrolovány léčbou kortikosteroidy, má být zváženo podání jiných systémových imunosupresiv.
* U pacientů s HNSCC léčených pembrolizumabem v kombinaci s chemoterapií + platinou a 5-FU (n = 276) byla incidence hypotyreózy 15,2 %, všechny případy byly stupně 1 nebo 2.
Detailní informace k incidenci vybraných imunitně zprostředkovaných nežádoucích účinků naleznete v aktuální verzi SPC LP Keytruda® na www.sukl.cz – ZDE.
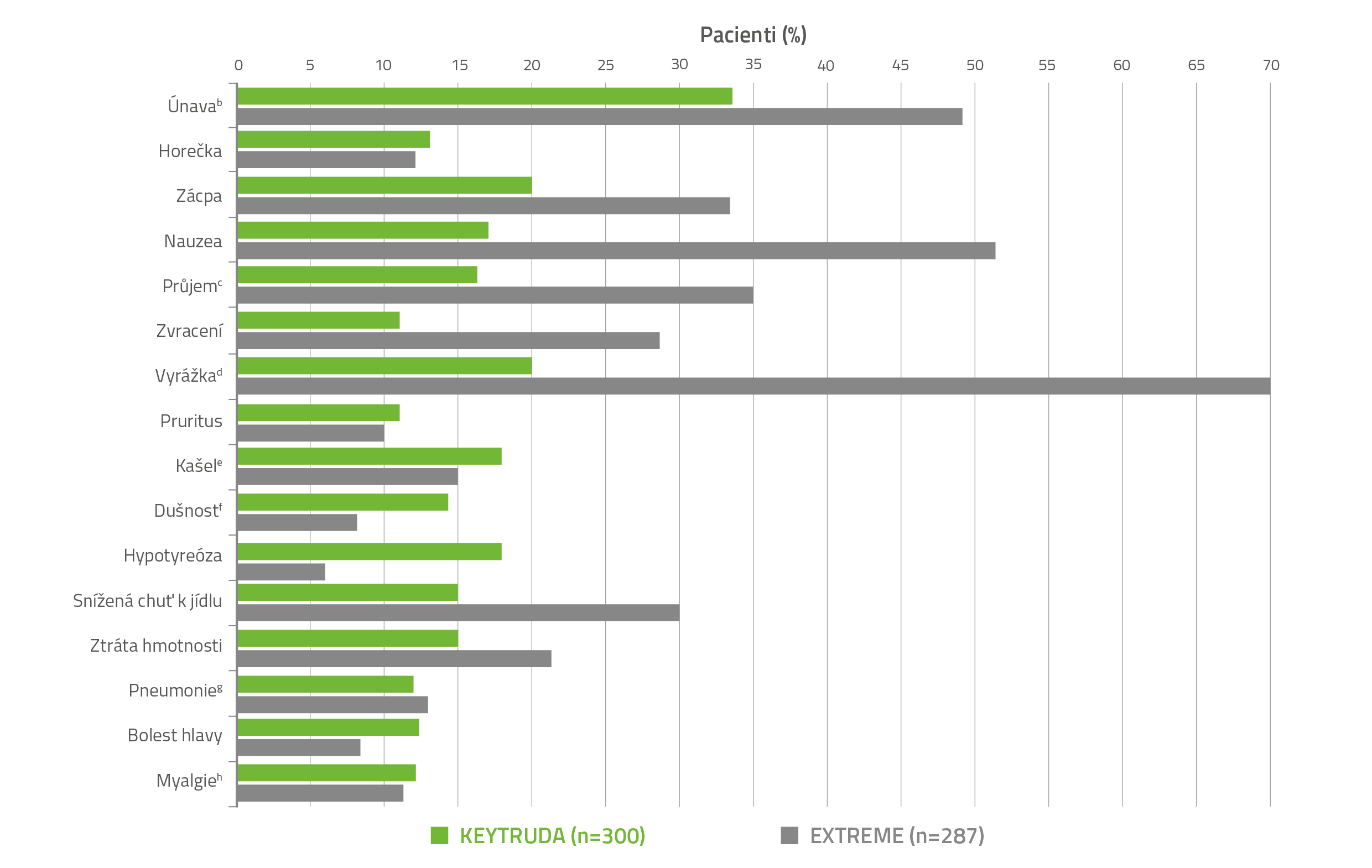
BEZPEČNOSTNÍ PROFIL PŘÍPRAVKU KEYTRUDA® V MONOTERAPII VS. REŽIM EXTREME2,3
NEŽÁDOUCÍ ÚČINKY (VŠECHNY STUPNĚ) S VÝSKYTEM U ≥ 10 % PACIENTŮ LÉČENÝCH PŘÍPRAVKEM KEYTRUDA® V MONOTERAPII VE STUDII KEYNOTE-048a
BEZPEČNOSTNÍ PROFIL PŘÍPRAVKU KEYTRUDA® + PLAT/FU VS. REŽIM EXTREME2,3
NEŽÁDOUCÍ ÚČINKY (VŠECHNY STUPNĚ) S VÝSKYTEM U ≥ 10 % PACIENTŮ LÉČENÝCH PŘÍPRAVKEM KEYTRUDA® + PLAT/FU VE STUDII KEYNOTE-048a
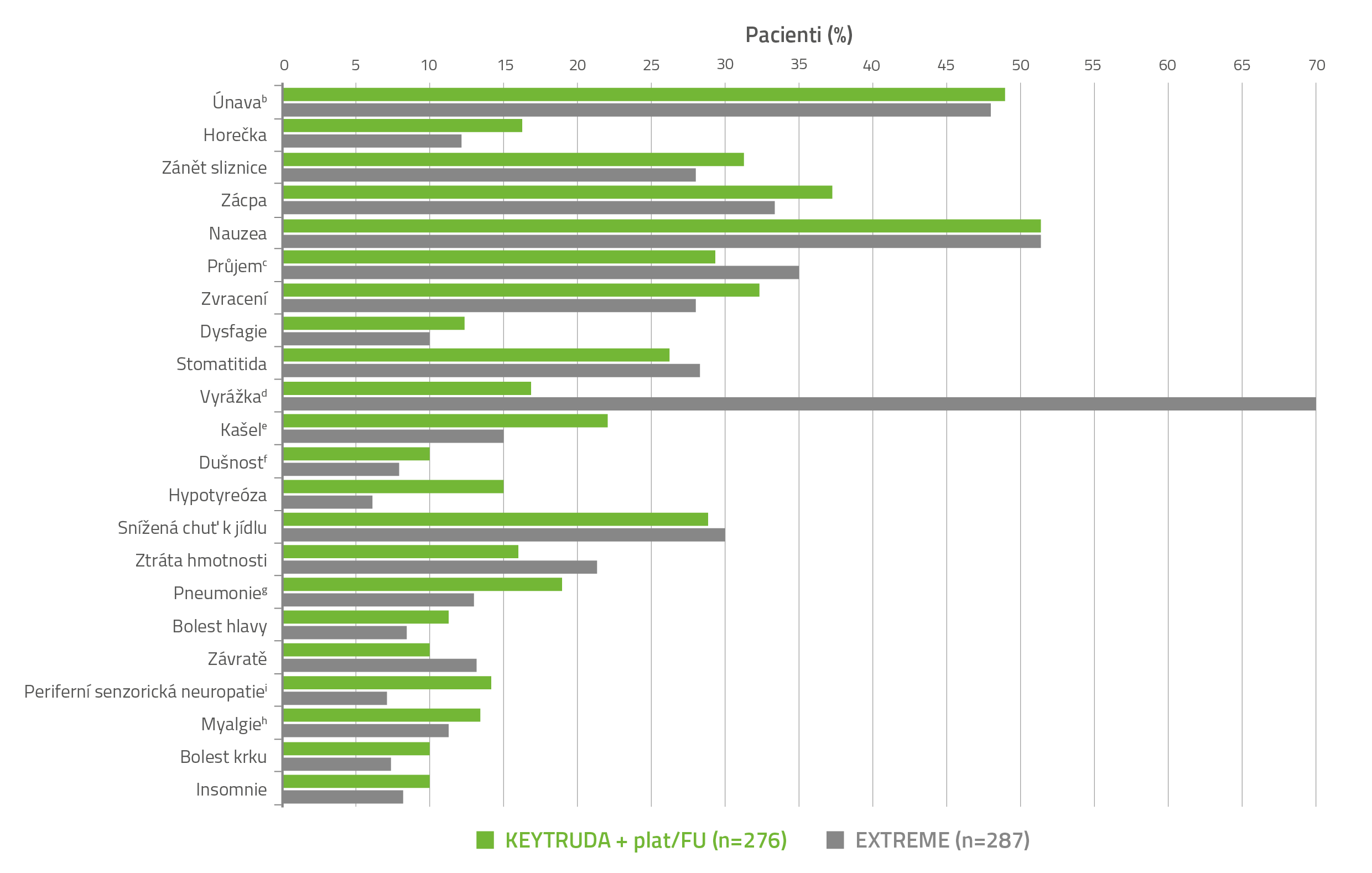
a Klasifikováno do stupňů dle NCI CTCAE v4.0.
b Zahrnuje únavu a astenii.
c Zahrnuje průjem, kolitidu, hemoragický průjem a mikroskopickou kolitidu.
d Zahrnuje dermatitidu, akneiformní dermatitidu, alergickou dermatitidu, bulózní dermatitidu, kontaktní dermatitidu, exfoliativní dermatitidu, polékový výsev, erytém, erythema multiforme, vyrážku, erytematózní vyrážku, generalizovanou vyrážku, makulózní vyrážku, makulopapulózní vyrážku, svědící vyrážku a seborrhoickou dermatitidu.
e Zahrnuje kašel a produktivní kašel.
f Zahrnuje dušnost a námahovou dušnost.
g Zahrnuje pneumonii, atypickou pneumonii, bakteriální pneumonii, stafylokokovou pneumonii, aspirační pneumonii, infekci dolních dýchacích cest, infekci plic a pseudomonádovou infekci plic.
h Zahrnuje bolest zad, muskuloskeletální bolest hrudníku, muskuloskeletální bolest a myalgii.
i Zahrnuje periferní senzorickou neuropatii, periferní neuropatii, hypestezii a dysestezii.
Zkratky:
CI = interval spolehlivosti
DOR = trvání odpovědi
ECOG PS = výkonnostní stav podle Eastern Cooperative Oncology Group
EXTREME = cetuximab + platina + fluorouracil
HNSCC = skvamózní karcinom hlavy a krku
HR = poměr rizik
M/nR HNSCC = metastatický nebo neresekovatelný rekurentní
NCI CTCAE = Národní institut pro rakovinu – Obecná terminologická kritéria pro nežádoucí účinky (National Cancer Institute Common Terminology Criteria for Adverse Events)
PD-L1 = ligand receptoru programované buněčné smrti 1
plat/FU = platina + fluorouracil
ORR = míra objektivní odpovědi
OS = celkové přežití
Reference:
1 SPC LP Keytruda®, datum revize 25. 2. 2025, na www.sukl.cz
2 Burtness B, et al. Pembrolizumab alone or with chemotherapy versus cetuximab with chemotherapy for recurrent or metastatic squamous cell carcinoma of the head and neck (KEYNOTE-048): a randomised, open-label, phase 3 study. Lancet 2019;10212:1915-1928.
3 Rischin D, et al. Protocol-specified final results of the KEYNOTE-048 trial of pembrolizumab as first-line therapy for recurrent/ metastatic head and neck squamous cell carcinoma (R/M HNSCC). Presented at the American Society of Clinical Oncology (ASCO) Annual Meeting, 31 May-4 June 2019.