
Bezpečnostní profil
Nežádoucí účinky s incidencí ≥ 5 % v kterékoliv skupině (léčená populace)1
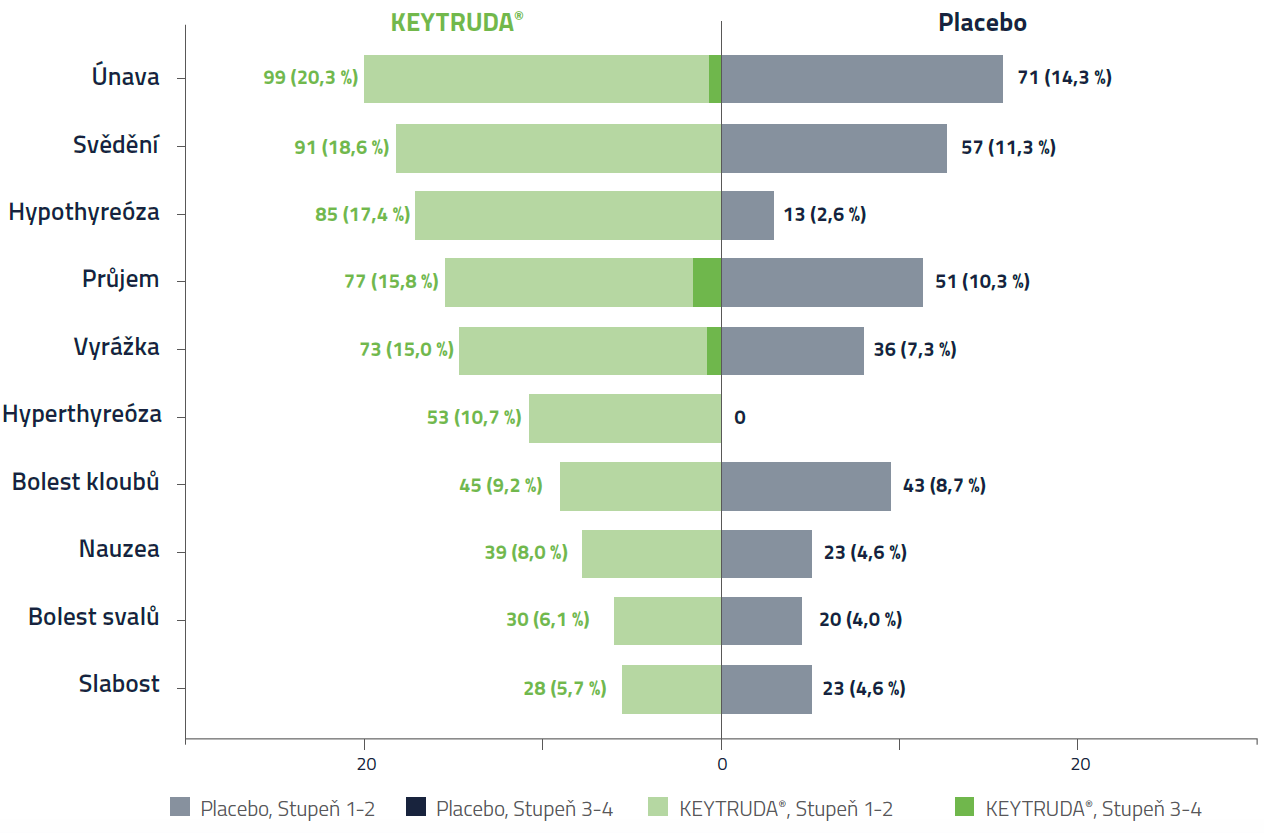
Celkem 994 pacientů bylo randomizováno buď k adjuvantní léčbě pembrolizumabem (496 pacientů), nebo k placebu (498 pacientů) (populace se záměrem léčit, ITT). Celkem 488 pacientů dostalo alespoň jednu dávku přípravku KEYTRUDA® a 496 dostalo alespoň jednu dávku placeba (léčená populace).
- Bezpečnost byla hodnocena u všech pacientů, kteří dostali alespoň jednu dávku přípravku KEYTRUDA® nebo placeba.
- Medián trvání expozice přípravku KEYTRUDA® byl 11,1 měsíce (rozmezí: 0,0 až 14,3 měsíce) vs. 11,1 měsíce (rozmezí 0,0 až 15,4 měsíce) u placeba.
- V léčené populaci se nežádoucí účinek jakéhokoliv stupně a jakékoliv příčiny vyskytl u 96,3 % pacientů léčených přípravkem KEYTRUDA® vs. 91,3 % pacientů dostávajících placebo.
- Celkem u 32,2 % pacientů léčených přípravkem KEYTRUDA® a 17,7 % pacientů dostávajících placebo se vyskytl nežádoucí účinek stupně 3 až 5.
- U 79,1 % pacientů léčených přípravkem KEYTRUDA® se vyskytly nežádoucí účinky související s léčbou (z nichž 18,6 % bylo stupně 3–5) vs. 53 % ve skupině s placebem (1,2 % stupně 3–5).
- V léčené populaci ukončilo léčbu z důvodu nežádoucího účinku 21,1 % pacientů léčených přípravkem KEYTRUDA® a 2,2 % pacientů na placebu.
Aktualizovaná bezpečnostní zjištění v populaci léčených pacientů
Během více než tří let sledování nebyly hlášeny žádné nové závažné nežádoucí účinky související s léčbou2
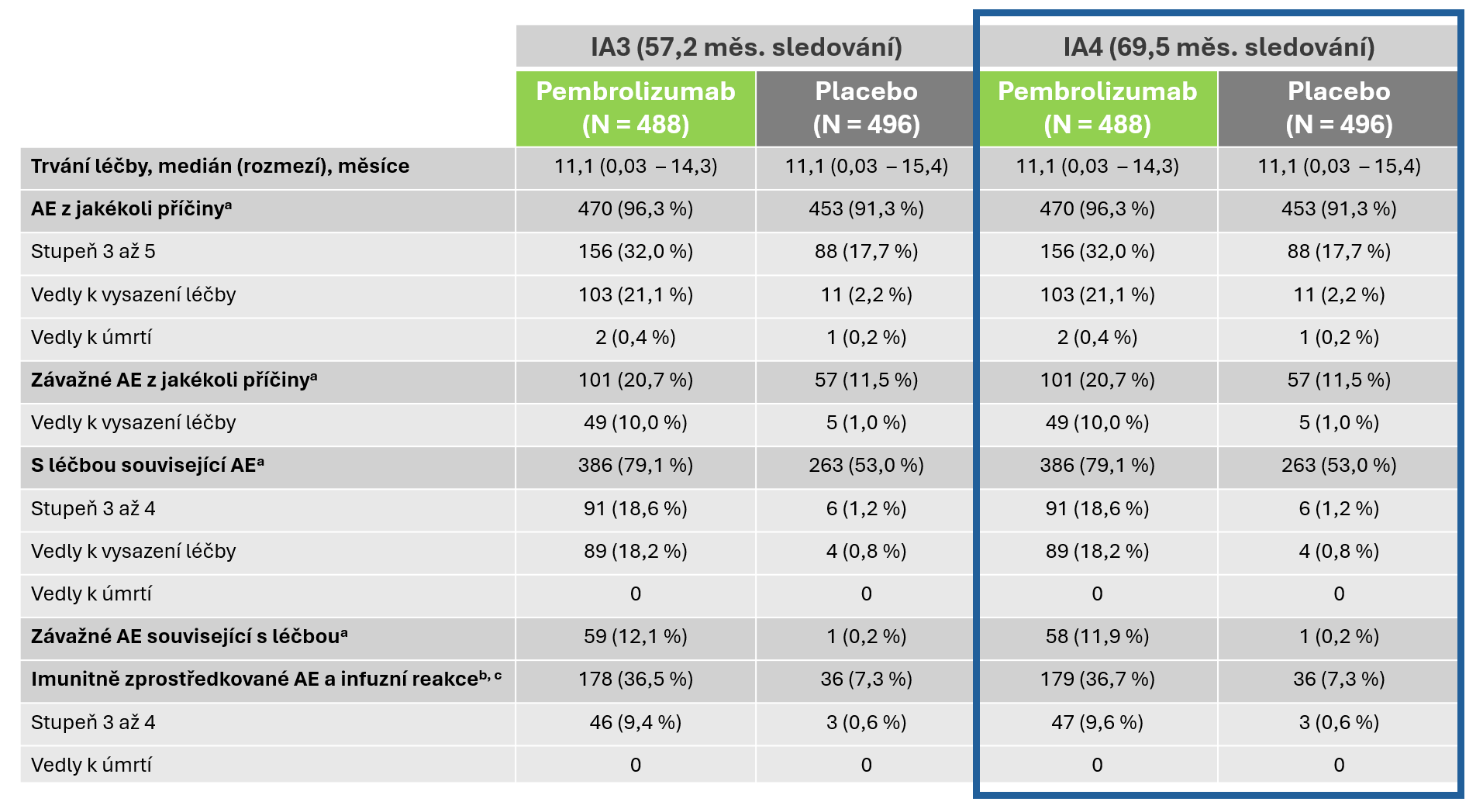
Medián doby sledování do data uzávěrky údajů (25. září 2024): 69,5 měsíce (rozmezí 60,2–86,9).
a Stupně AE byly určovány podle NCI CTCAE v4.0 a AE byly hlášeny od randomizace do 30 dní (90 dní u závažných AE) po vysazení hodnocené terapie.
b Na základě seznamu preferovaných pojmů určených k zachycení známých rizik pembrolizumabu a skutečnosti, že byly zařazeny bez ohledu na to, zda je zkoušející považoval za související s hodnocenou léčbou.
c Vysoké dávky systémových kortikosteroidů (≥ 40 mg za den) byly podávány 37 (8 %) účastníkům s mediánem 7 dní v rameni léčeném pembrolizumabem a 3 (1 %) účastníkům s mediánem 3 dny v rameni léčeném placebem.
VYBRANÉ NEŽÁDOUCÍ ÚČINKY3
Závažné a fatální imunitně zprostředkované nežádoucí účinky
LP KEYTRUDA® je monoklonální protilátka patřící do skupiny léčiv, které se vážou buď na receptor programované buněčné smrti PD-1 (programmed cell death-1) nebo jeho ligand PD-L1 a způsobují tak zablokování signální cesty PD-1/PD-L1. To vede ke zrušení inhibice imunitní odpovědi, což může potenciálně způsobit narušení periferní tolerance a indukovat imunitně zprostředkované nežádoucí účinky. Imunitně zprostředkované nežádoucí účinky, které mohou být závažné nebo fatální, mohou postihnout kterýkoliv orgánový systém nebo tkáň, mohou se vyskytnout ve více orgánových systémech současně a mohou se objevit kdykoliv po zahájení léčby nebo po jejím ukončení. Důležité imunitně zprostředkované nežádoucí účinky, které jsou zde vyjmenovány, nemusí zahrnovat veškeré možné závažné a fatální imunitně zprostředkované nežádoucí účinky.
Pečlivě pacienty sledujte stran výskytu příznaků a známek, které by mohly být klinickou manifestací imunitně zprostředkovaných nežádoucích účinků. Jejich časná identifikace a léčba je pro bezpečné užití léčby cílené na PD-1/PD-L1 zásadní. Před zahájením léčby a pak pravidelně v jejím průběhu mají být sledovány hladiny jaterních enzymů, kreatininu a funkce štítné žlázy. Při podezření na imunitně zprostředkované nežádoucí účinky má být zajištěno odpovídající vyšetření, aby se vyloučily jiné příčiny, včetně infekce. Dle situace může být vyžadováno zahájení okamžité lékařské intervence, včetně konzultace se specialisty.
V závislosti na závažnosti imunitně zprostředkovaného nežádoucího účinku má být LP KEYTRUDA® dočasně nebo trvale vysazen. Obecně, pokud je nutné léčbu LP KEYTRUDA® přerušit nebo ji vysadit, mají být podávány systémové kortikosteroidy (1 až 2 mg/kg/den prednisonu nebo jeho ekvivalentu), dokud nedojde ke zlepšení na stupeň 0 nebo 1. Jakmile dojde ke zlepšení nežádoucího účinku na stupeň 0 nebo 1, má být zahájeno postupné vysazování kortikosteroidu trvající minimálně 1 měsíc. U pacientů, jejichž nežádoucí účinky nejsou dostatečně kontrolovány léčbou kortikosteroidy, má být zváženo podání jiných systémových imunosupresiv.
Reference:
1 Choueiri TK, Tomczak P, Park SH, et al. Overall survival with adjuvant pembrolizumab in renal-cell carcinoma. N Engl J Med 2024;390:1359-1371
2 Haas, N. B., et al. (2025). Five-year follow-up results from the phase 3 KEYNOTE-564 study of adjuvant pembrolizumab for the treatment of clear cell renal cell carcinoma. Journal of Clinical Oncology, 43(16_suppl), Abstract 4514. https://ascopubs.org/doi/pdfdirect/10.1200/JCO.2025.43.16_suppl.4514.
3 SPC přípravku KEYTRUDA® na www.sukl.cz.