
Bezpečnost
KEYTRUDA® + EV: bezpečnostní profil1,2,3
Nežádoucí účinky související s léčboua
Mezi pacienty s LA/mUC léčenými kombinací KEYTRUDA® + EV byly nežádoucí účinky celkově podobné jako u pacientů léčených přípravkem KEYTRUDA® nebo EV v monoterapii
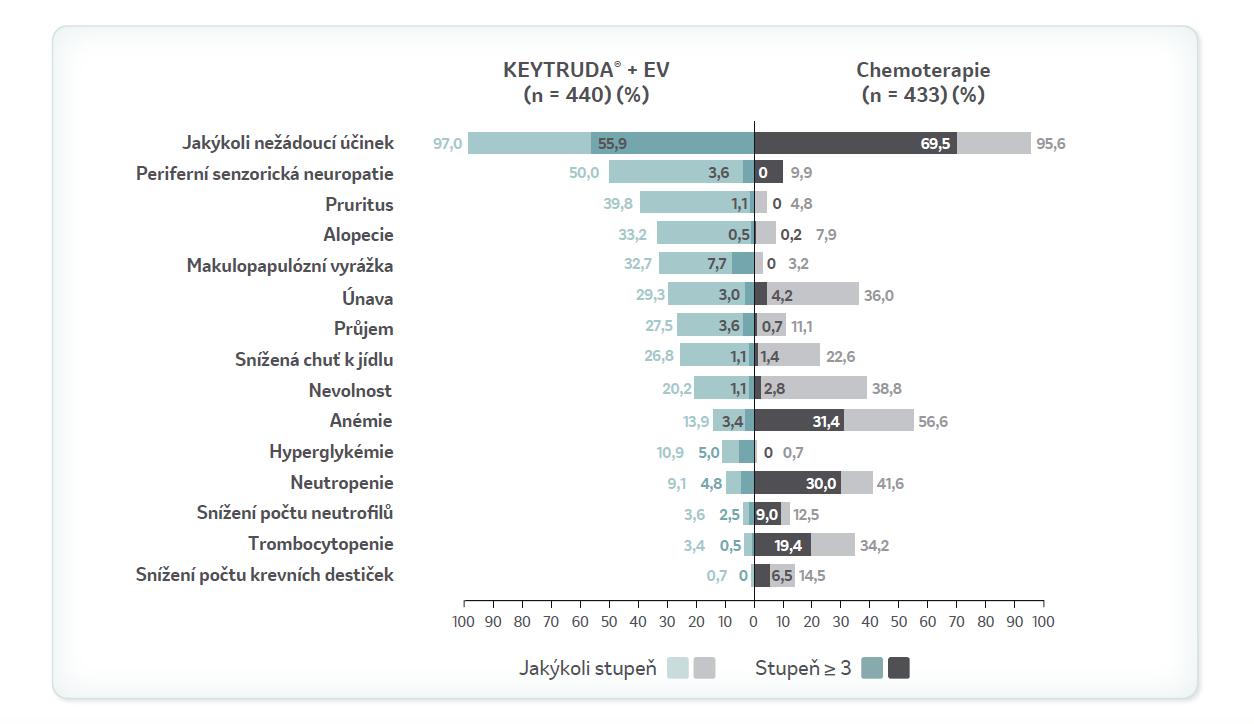
a Zahrnuty jsou nežádoucí účinky související s léčbou, které se vyskytly u alespoň 20 % pacientů v kterékoli léčebné skupině, a nežádoucí účinky stupně 3 nebo vyššího související s léčbou, které se vyskytly u alespoň 5 % pacientů v kterékoli léčebné skupině. Nežádoucí účinky související s léčbou jsou takové, u kterých podle hodnocení zkoušejícího existuje přiměřená možnost, že byly způsobeny léčbou, jež je předmětem studie. Tato analýza zahrnovala všechny pacienty, kterým byla podána jakákoli dávka léčby sledované v této studii.
Nejčastější (≥ 20 %) nežádoucí příhody související s léčbou kombinací EV + P2,3,4
V dalším 1 roce následného sledování zůstal bezpečnostní profil kombinace EV + P konzistentní
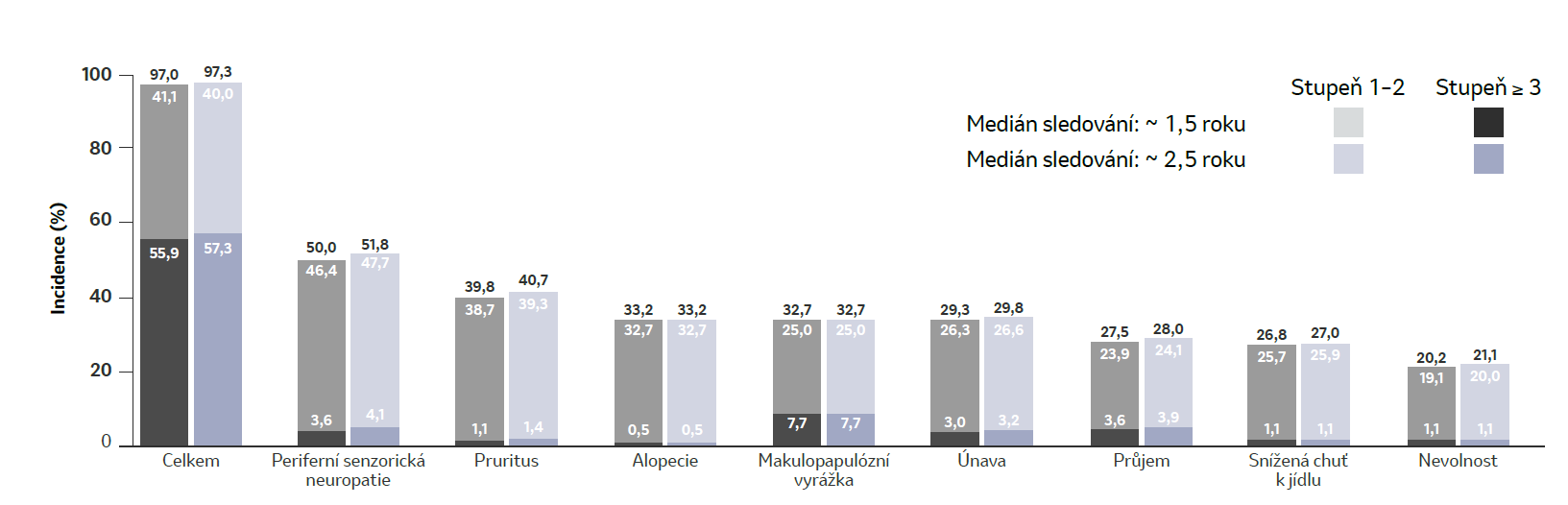
- Po dalším 1 roce následného sledování nebyly pozorovány žádné nové bezpečnostní signály
- Četnost a stupeň TRAEs zůstaly konzistentní s primární analýzou
Uzávěrka dat: 8. srpna 2024
KEYTRUDA® + EV: vybrané údaje o bezpečnostním profilu1,5
Výskyt makulopapulózní vyrážky (jakéhokoli stupně) při léčbě touto kombinací přípravků byl 36 % (10 % stupně 3-4), což je více, než bylo pozorováno při podávání přípravku KEYTRUDA® v monoterapii.
Medián trvání léčby přípravkem KEYTRUDA® byl 8,5 měsíce (rozmezí od 0,3 do 28,5) s mediánem počtu 11 cyklů (rozmezí od 1 do 35).
Fatální nežádoucí účinky
- Nežádoucí účinky související s léčbou, které vedly k úmrtí (syndrom multiorgánové dysfunkce, imunitně zprostředkované plicní onemocnění, průjem a astenie), se vyskytly u 4 pacientů (< 1,0 %) ve skupině léčené kombinací KEYTRUDA® + EV.
Závažné nežádoucí účinky
- Nežádoucí účinky stupně 3 nebo vyššího související s léčbou se vyskytly u 55,9 % pacientů ve skupině léčené kombinací KEYTRUDA® + EV.
- Nejčastější nežádoucí účinky stupně 3 nebo vyššího související s léčbou byly makulopapulózní vyrážka (7,7 %), hyperglykémie (5,0 %) a neutropenie (4,8 %) ve skupině pacientů léčených kombinací KEYTRUDA® + EV.
- Ve skupině pacientů léčených kombinací KEYTRUDA® + EV byly nejčastějšími nežádoucími účinky stupně 3 nebo vyššího, které byly předmětem zvláštního zájmu a dříve byly spojovány s léčbou přípravkem KEYTRUDA®, závažné kožní reakce (11,8 % pacientů), pneumonitida (3,6 %) a hepatitida (1,8 %).
Medián doby do nástupu vybraných nežádoucích účinků u pacientů s mUC léčených kombinací pembrolizumab + EV6
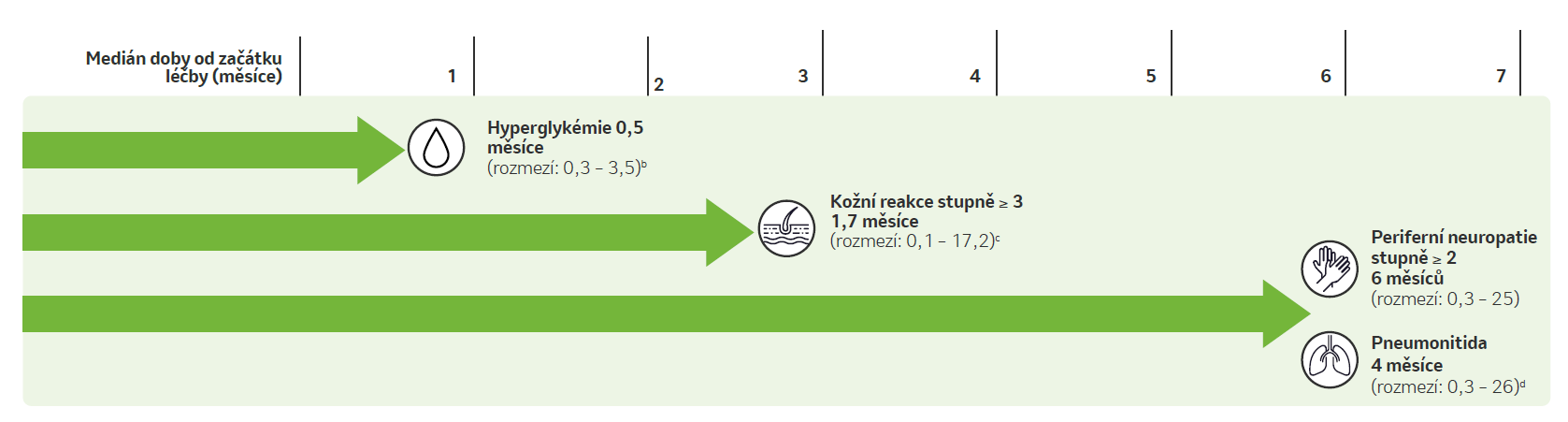
- Existuje určitý vzorec ohledně doby nástupu příslušných nežádoucích účinků, nežádoucí účinky se nicméně mohou objevit kdykoli.
b Doba do prvního nástupu v kohortě s eskalací dávky / kohortě A (n = 45). Medián doby do nástupu v kohortě K byl 0,53 měsíce (n = 76);
c Kožní reakce jakéhokoli stupně se mohou objevit již v prvním cyklu;
d Zkrácená informace o přípravku EV pro USA používá termín pneumonitida / intersticiální plicní nemoc.
Klíčové body ke zvážení při řešení nežádoucích účinků u pacientů s mUC léčených kombinací pembrolizumab + EV6
Autoři poukazují na čtyři klíčová doporučení na podporu efektivní léčby pacientů léčených kombinací pembrolizumab + EV

e Úprava dávkování může zahrnovat pozdržení dávek (odložení cyklu, vynechání dávek), vysazení jednoho nebo obou přípravků, nebo snížení dávky EV. Snížení dávky pembrolizumabu se nedoporučuje.
Reference:
1 Powles T, Valderrama BP, Gupta S, et al. Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med. 2024;390(10):875-888. doi:10.1056/NEJMoa2312117.
2 Powles T, et al. EV-302: Updated analysis from the phase 3 global study of enfortumab vedotin in combination with pembrolizumab (EV+P) vs chemotherapy (chemo) in previously untreated locally advanced or metastatic urothelial carcinoma (la/mUC) presented at ASCO GU, February 13 – 15, 2025 in San Francisco.
3 Powles TB, Van der Heijden MS, Loriot Y, et al. Enfortumab vedotin plus pembrolizumab in untreated locally advanced or metastatic urothelial carcinoma: 2.5-year median follow-up of the phase III EV-302/KEYNOTE-A39 trial. Ann Oncol. 2025;36(10):1212-1219. doi:10.1016/annonc.2025.05.356.
4 Powles T, et al. N Engl J Med. 2024;390(10):875-88.
5 Powles T, Valderrama BP, Gupta S, et al. Supplementary appendix to: Enfortumab vedotin and pembrolizumab in untreated advanced urothelial cancer. N Engl J Med. 2024;390:875-888. doi:10.1056/NEJMoa2312117.
6 Brower B et al. Front Oncol 2024;14:1326715.
Zkratky:
EV = enfortumab vedotin
ICI = inhibitor kontrolního bodu imunitní odpovědi (checkpoint inhibitor)
LA/mUC = lokálně pokročilý/metastatický uroteliální karcinom
mUC = metastazující uroteliální karcinom
NCI CTCAE = terminologická kritéria nežádoucích účinků podle Národního institutu pro rakovinu (National Cancer Institute Common Terminology Criteria for Adverse Events)
P = pembrolizumab
SL = vedoucí vědecký pracovník
TRAE = nežádoucí účinek související s léčbou