Bezpečnost1
Souhrn bezpečnostního profilu ve studii KEYNOTE-A18 pro ITT populaci
UPOZORNĚNÍ: Výše uvedená data o účinnosti se vztahují na celou ITT populaci (n = 1 060), mimo jiné včetně pacientek s karcinomem děložního hrdla stádia III–IVA dle FIGO 2014 (n = 601).2
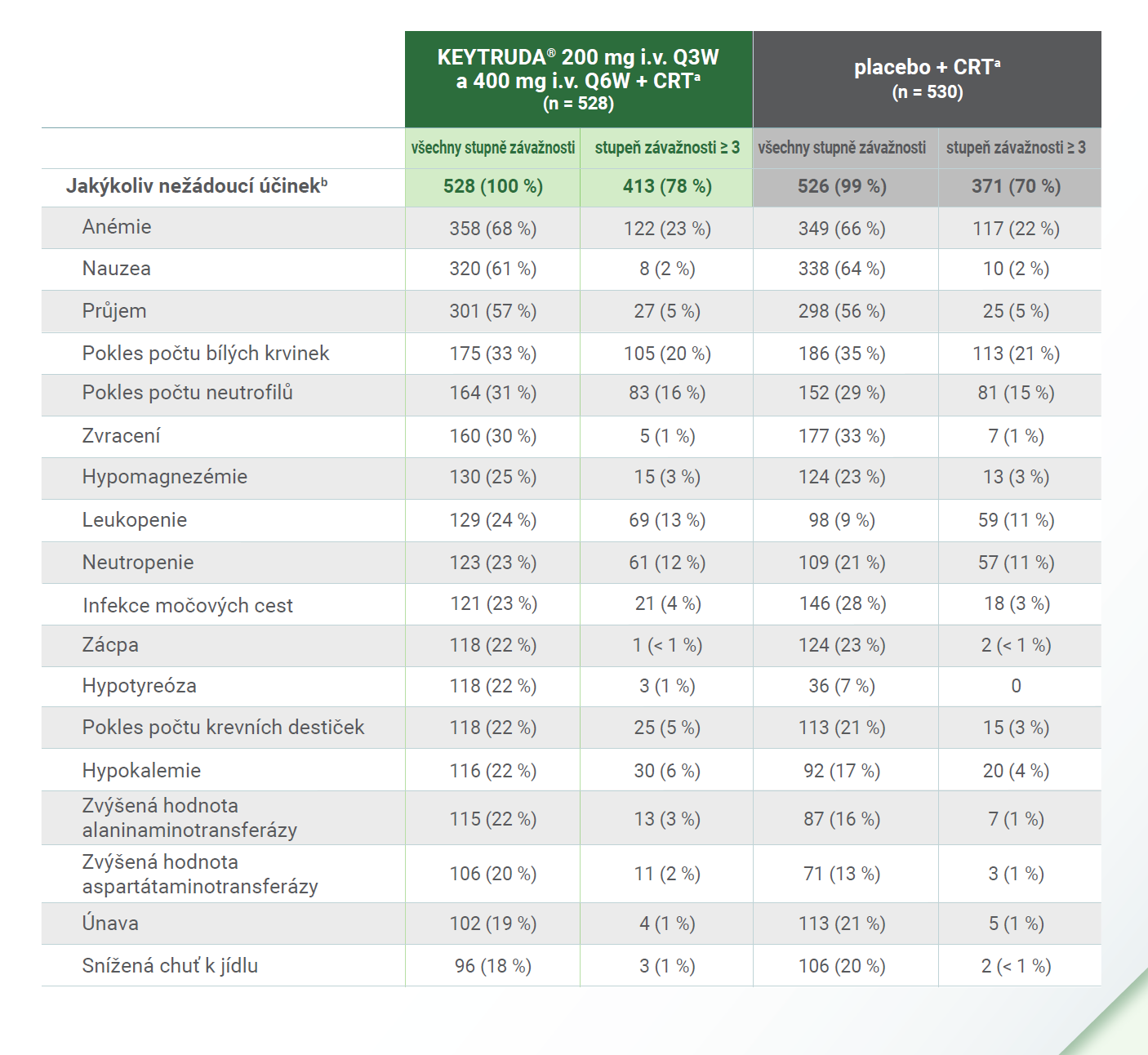
Nežádoucí účinkyb, ke kterým došlo u léčené populace2
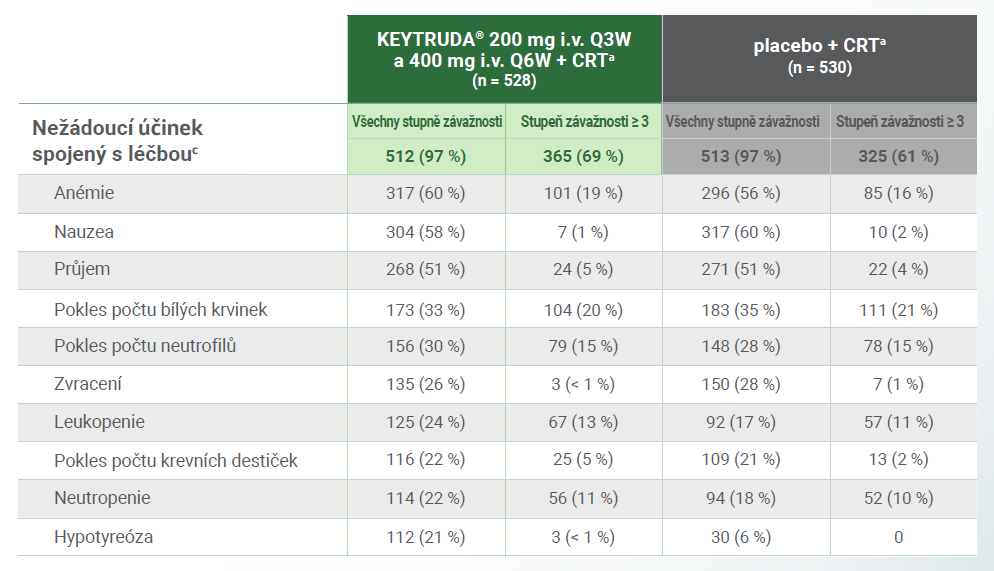
Nežádoucí účinky spojené s léčbouc, ke kterým došlo u léčené populace2
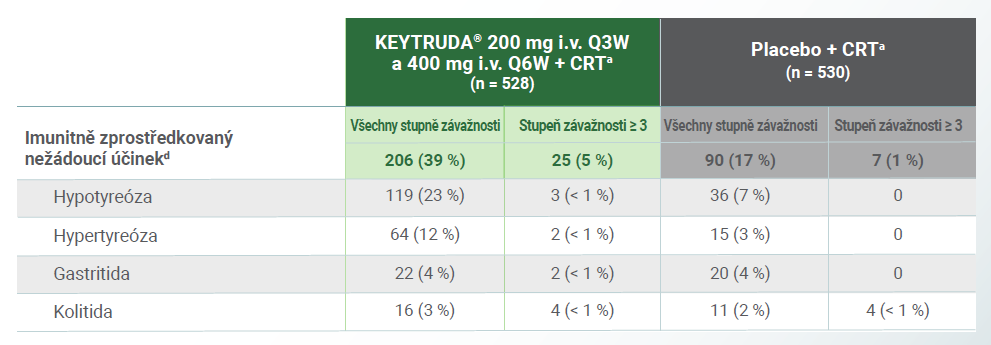
Imunitně zprostředkované nežádoucí účinkyd, ke kterým došlo u léčené populace2
Podrobné informace o výskytu a závažnosti konkrétního nežádoucího účinku naleznete v SPC léčebného přípravku nebo v publikacích hodnocení studií.
a Cisplatina 40 mg/m2 i.v. jednou týdně (5 cyklů; volitelná šestá infuze mohla být podána podle lokálních postupů) a radioterapie (EBRT následovaná BRT).
b Nežádoucí účinky, které se vyskytly během období léčby nebo do 30 dnů po období léčby (v případě závažných účinků do 90 dnů). Léčená populace zahrnovala všechny pacientky, které v rámci randomizace obdržely alespoň jeden hodnocený přípravek. Závažnost nežádoucích účinků byla hodnocena podle Obecných terminologických kritérií nežádoucích účinků National Cancer Institute Common Terminology Criteria for Adverse Events verze 5.0.
c Nežádoucí účinky spojené s léčbou byly ty, které zkoušející přisoudili hodnocené léčbě. Nežádoucí účinky jsou uvedeny v sestupném pořadí frekvence ve skupině léčené kombinací přípravku KEYTRUDA® + CRTa. U pacientek se mohl vyskytnout více než jeden účinek. Nežádoucí účinky související s léčbou stupně 5 byly imunitně zprostředkovaná gastritida (n = 1) a perforace tlustého střeva (n = 1) ve skupině léčené kombinací přípravku KEYTRUDA® + CRTa a selhání kostní dřeně (n = 1) a neutropenická kolitida (n = 1) ve skupině léčené kombinací placebo + CRTa.
d Imunitně zprostředkované nežádoucí účinky byly stanoveny podle seznamu podle seznamu termínů specifikovaných zadavatelem bez ohledu na to, zda je zkoušející považoval za související s hodnocenou léčbou. Byly hlášeny nežádoucí účinky zvláštního zájmu, které se vyskytly nejméně u 15 pacientek v některé z léčebných skupin.
Reference:
1 SPC přípravku KEYTRUDA® na www.sukl.cz.
2 Lorusso D, Xiang Y, Hasegawa K et al. Pembrolizumab or placebo with chemoradiotherapy followed by pembrolizumab or placebo for newly diagnosed, highrisk, locally advanced cervical cancer (ENGOT-cx11/GOG-3047/KEYNOTE-A18): overall survival results from a randomised, double-blind, placebocontrolled, phase 3 trial. Lancet. 2024;404(10460):1321-32.
Zkratky:
BRT = brachyterapie
CRT = chemoradioterapie
EBRT = zevní radioterapie
FIGO = International Federation of Gynecology and Obstetrics (Mezinárodní federace gynekologie a porodnictví)
ITT = záměr léčit
i.v. = intravenózní
n = počet
Q3W = každé 3 týdny
Q6W = každých 6 týdnů