Bezpečnost KEYNOTE-045
Bezpečnost
KEYNOTE-045: Klinická studie s pacienty v druhé linii po selhání léčby platinou1
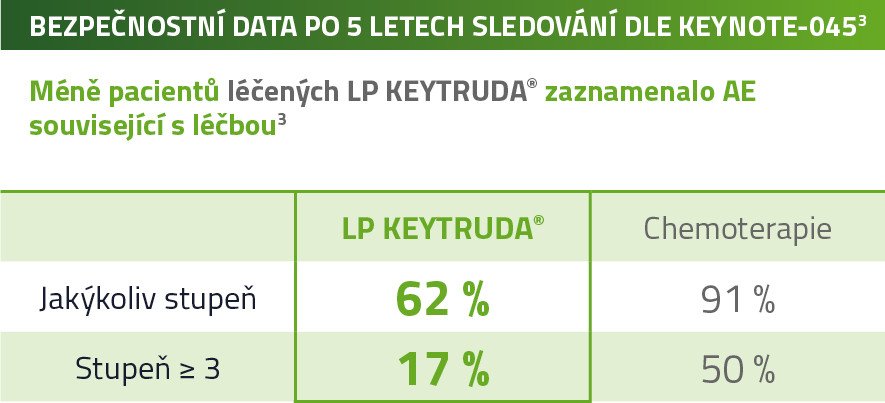
Většina častých nežádoucích účinků při léčbě LP KEYTRUDA® 200 mg à 3 týdny byla stupně 1 nebo 2.
Nežádoucí účinky s výskytem u ≥ 20 % pacientů léčených LP KEYTRUDA® v klinické studii KEYNOTE-045
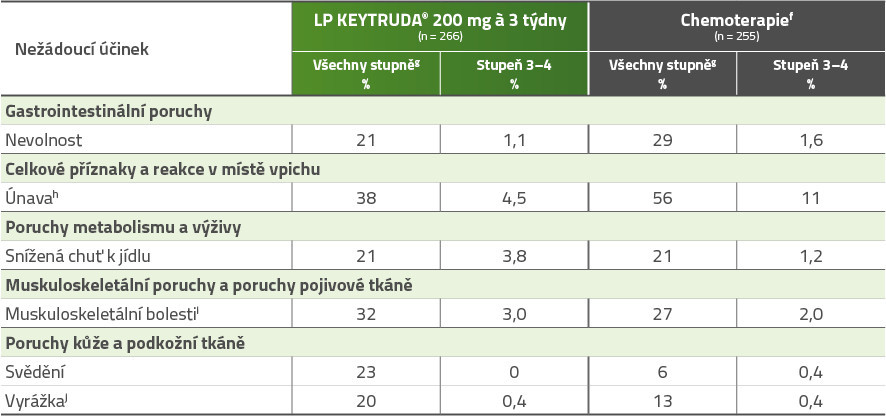
a Chemoterapie: paklitaxel, docetaxel nebo vinflunin.
b Klasifikováno do stupňů dle National Cancer Institute-Common Terminology Criteria for Adverse Events (NCI-CTCAE) v4.0.
c Zahrnuje astenii, únavu, malátnost a letargii.
d Zahrnuje bolest zad, myalgii, bolest kostí, muskuloskeletální bolest, bolest končetin, muskuloskeletální bolest hrudníku, muskuloskeletální diskomfort a bolest krku.
e Zahrnuje makulopapulózní vyrážku, genitální vyrážku, erytematózní vyrážku, papulózní vyrážku, svědící vyrážku, pustulózní vyrážku, erytém, lékové erupce, ekzém, asteatotický ekzém, kontaktní dermatitidu, akneiformní dermatitidu, dermatitidu, seborrhoickou keratitidu a lichenoidní keratitidu.
- Léčba LP KEYTRUDA® byla z důvodu nežádoucích účinků ukončena u 8 % pacientů. Nejčastějším nežádoucím účinkem, který vedl k trvalému ukončení léčby LP KEYTRUDA®, byla pneumonitida (1,9 %).
- Nežádoucí účinky, které vedly k přerušení léčby LP KEYTRUDA®, se vyskytly u 20 % pacientů, přičemž nejčastějšími (≥ 1 %) byly infekce močových cest (1,5 %), průjem (1,5 %) a kolitida (1,1 %).
- Závažné nežádoucí účinky se vyskytly u 39 % pacientů léčených LP KEYTRUDA®. Nejčastější závažné nežádoucí účinky (≥ 2 %) u pacientů léčených LP KEYTRUDA® byly infekce močových cest, pneumonie, anemie a pneumonitida.
VYBRANÉ NEŽÁDOUCÍ ÚČINKY
Závažné a fatální imunitně zprostředkované nežádoucí účinky
LP KEYTRUDA® je monoklonální protilátka patřící do skupiny léčiv, které se vážou buď na receptor programované buněčné smrti PD-1 (programmed cell death-1) nebo jeho ligand PD-L1 a způsobují tak zablokování signální cesty PD-1/PD-L1. To vede ke zrušení inhibice imunitní odpovědi, což může potenciálně způsobit narušení periferní tolerance a indukovat imunitně zprostředkované nežádoucí účinky. Imunitně zprostředkované nežádoucí účinky, které mohou být závažné nebo fatální, mohou postihnout kterýkoliv orgánový systém nebo tkáň, mohou se vyskytnout ve více orgánových systémech současně a mohou se objevit kdykoliv po zahájení léčby nebo po jejím ukončení. Důležité imunitně zprostředkované nežádoucí účinky, které jsou zde vyjmenovány, nemusí zahrnovat veškeré možné závažné a fatální imunitně zprostředkované nežádoucí účinky.
Pečlivě pacienty sledujte stran výskytu příznaků a známek, které by mohly být klinickou manifestací imunitně zprostředkovaných nežádoucích účinků. Jejich časná identifikace a léčba je pro bezpečné užití léčby cílené na PD-1/PD-L1 zásadní. Před zahájením léčby a pak pravidelně v jejím průběhu mají být sledovány hladiny jaterních enzymů, kreatininu a funkce štítné žlázy. Při podezření na imunitně zprostředkované nežádoucí účinky má být zajištěno odpovídající vyšetření, aby se vyloučily jiné příčiny, včetně infekce. Dle situace může být vyžadováno zahájení okamžité lékařské intervence, včetně konzultace se specialisty.
V závislosti na závažnosti imunitně zprostředkovaného nežádoucího účinku má být LP KEYTRUDA® dočasně nebo trvale vysazen. Obecně, pokud je nutné léčbu LP KEYTRUDA® přerušit nebo ji vysadit, mají být podávány systémové kortikosteroidy (1 až 2 mg/kg/den prednisonu nebo jeho ekvivalentu), dokud nedojde ke zlepšení na stupeň 0 nebo 1. Jakmile dojde ke zlepšení nežádoucího účinku na stupeň 0 nebo 1, má být zahájeno postupné vysazování kortikosteroidu trvající minimálně 1 měsíc. U pacientů, jejichž nežádoucí účinky nejsou dostatečně kontrolovány léčbou kortikosteroidy, má být zváženo podání jiných systémových imunosupresiv.
INCIDENCE VYBRANÝCH IMUNITNĚ ZPROSTŘEDKOVANÝCH NEŽÁDOUCÍCH ÚČINKŮ2
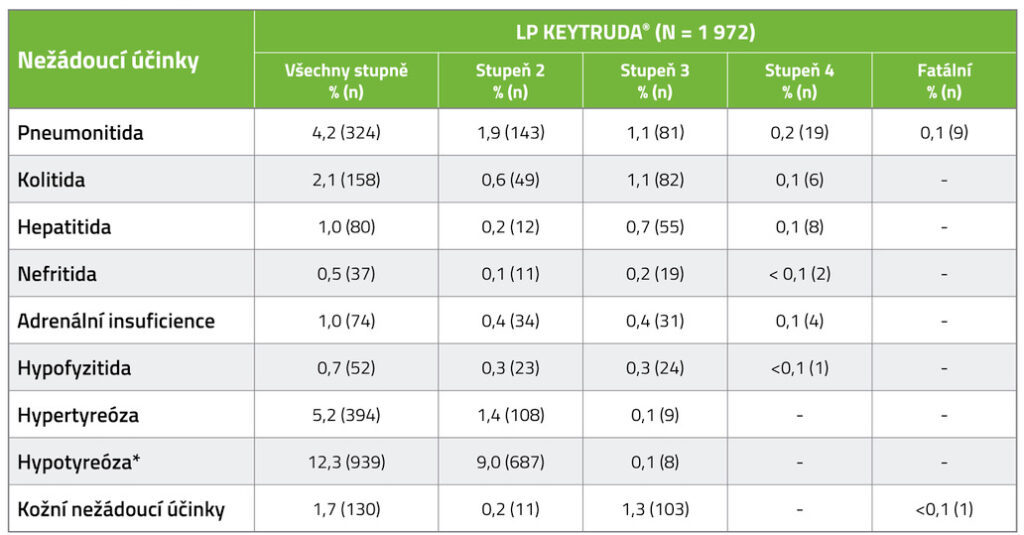
* U pacientů s HNSCC léčených pembrulizumabem v kombinaci s chemoterapií + platinou a 5-FU (n = 276) byla incidence hypotyreózy 15,2 %, všechny případy byly stupně 1 nebo 2.
Detailní informace k incidenci vybraných imunitně zprostředkovaných nežádoucích účinků naleznete v SPC LP Keytruda® ZDE.
Reference:
1 Bellmunt J, Necchi A, de Wit R, et al. Pembrolizumab (pembro) versus investigator’s choice of paclitacel, docetaxel, or vinflunine in recurrent, advanced urothelial cancer (UC): 5-year follow-up from the phase 3 KEYNOTE-045 trial, Journal of Clinical Oncology. 2021; 39 (suppl.15): Abstract 4532.
2 SPC LP Keytruda®