Design klinické studie KEYNOTE-775
Design klinické studie1
Randomizovaná, multicentrická, otevřená, aktivně kontrolovaná studie fáze 3 porovnávající kombinovanou léčbu přípravky KEYTRUDA® + LENVIMA® oproti doxorubicinu nebo paklitaxelu u pacientek (n = 827) s pokročilým endometriálním karcinomem.1
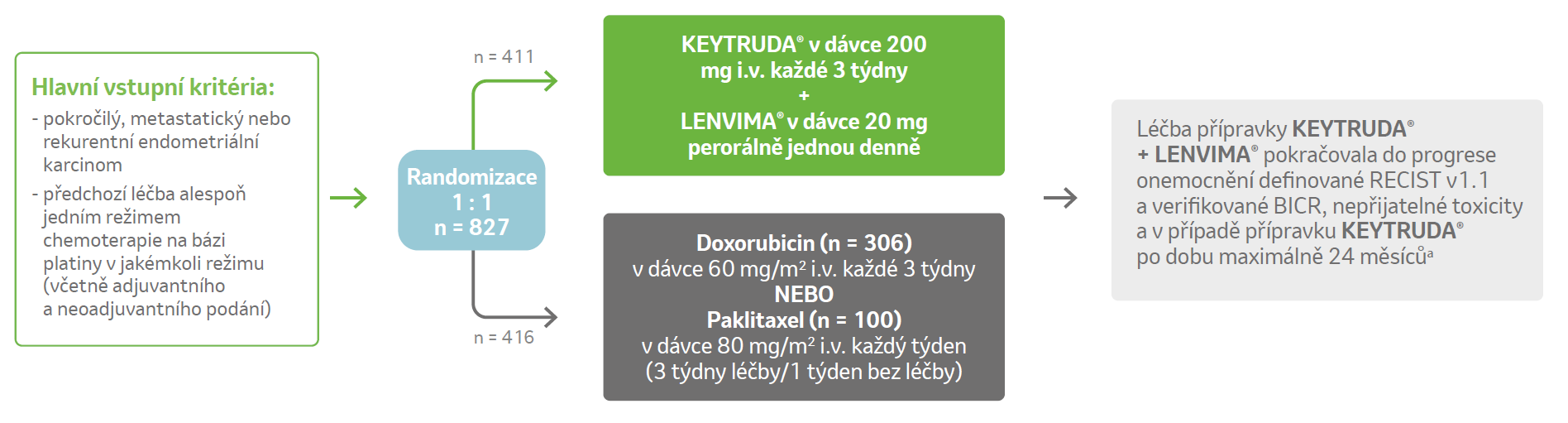
Hlavní vylučující kritéria:
– endometriální sarkom, včetně karcinosarkomu
– aktivní autoimunitní onemocnění
– zdravotní stav vyžadující imunosupresi
– již existující píštěl stupně ≥ 3
– nekontrolovaný krevní tlak (> 150/90 mmHg)
– významná porucha kardiovaskulárního systému nebo příhoda během předchozích 12 měsíců
Stratifikační faktory:
MMR status (pMMR vs. dMMR) a další stratifikace v rámci pMMR podle:
– region (R1: Evropa, USA, Kanada, Austrálie, Nový Zéland a Izrael vs. R2: zbytek světa)
– ECOG PS (0 vs. 1)
– anamnéza ozáření pánve (ano vs. ne)
Primární cílové parametry účinnosti
- celkové přežití (OS)
- přežití bez progrese (PFS)
Sekundární cílové parametry účinnosti
- ORR stanovené BICR podle RECIST v1.1
- se zdravím související kvalita života
- bezpečnost
a Léčba po progresi onemocnení definované RECIST v1.1 byla povolena, pokud zkoušející usoudil, že pacient má z léčby klinický přínos a dobře ji toleruje.
b Hodnoceno BICR podle RECIST v1.1.
BICR = zaslepené nezávislé centrální hodnocení; ECOG PS = výkonnostní stav podle Eastern Cooperative Oncology Group; i.v. = intravenózne; RECIST v1.1. = kritéria hodnocení odpovědi u solidních nádoru verze 1.1.
Reference:
1. Makker V et al. N Engl J Med 2022; 386: 437-448.