Indikace
RCC
Adjuvantní léčba renálního karcinomu
Indikace
LP KEYTRUDA® je v monoterapii indikován k adjuvantní léčbě dospělých s renálním karcinomem (renal cell carcinoma, RCC) se zvýšeným rizikem rekurence po nefrektomii, nebo po nefrektomii a resekci metastatických lézí.1
Vhodný pacient
Vstupní kritéria

aPacienti s metastatickým onemocněním, kteří podstoupili kompletní resekci primárního nádoru a metastatických lézí.
Vylučující kritéria: pacienti s aktivním autoimunitním onemocněním nebo zdravotním stavem vyžadujícím imunosupresi byli vyloučeni.
M0 = bez metastáz; M1 = vzdálené metastázy; N0 = bez metastáz v regionálních lymfatických uzlinách; N1 = postižení regionálních lymfatických uzlin; pT = primární nádor.
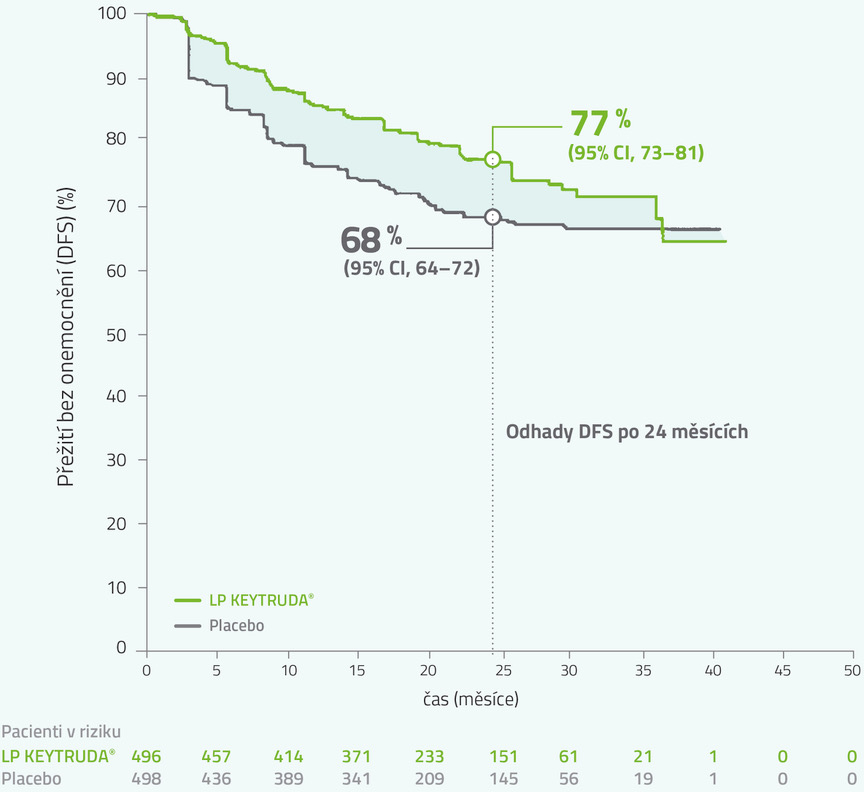
Výsledky klinické studie KEYNOTE-564
Výsledky klinické studie KEYNOTE-564: primární analýza (medián sledování 24 měsíců)

Kaplan-Meierovy odhady přežití bez onemocnění (DFS) v klinické studii KEYNOTE-5643
Medián času od randomizace do uzavření databáze: 24,1 měsíce (rozmezí: 14,9–41,5 měsíce)
Další informace
Pozorované příhody: 109/496 (22 %) u LP KEYTRUDA® vs. 151/498 (30 %) u placeba.
Medián DFS: nedosažen ani v jedné skupině.
V době analýzy DFS nebyla data pro OS dostatečně zralá, úmrtí bylo zaznamenáno u 5 % celkové populace.
bNa základě stratifikovaného Coxova modelu proporcionálních rizik.
cNa základě stratifikovaného log rank testu.
dHodnota p (jednostranná) je srovnána s hranicí 0,0114.
DFS = přežití bez onemocnění; HR = poměr rizik; CI = interval spolehlivosti.
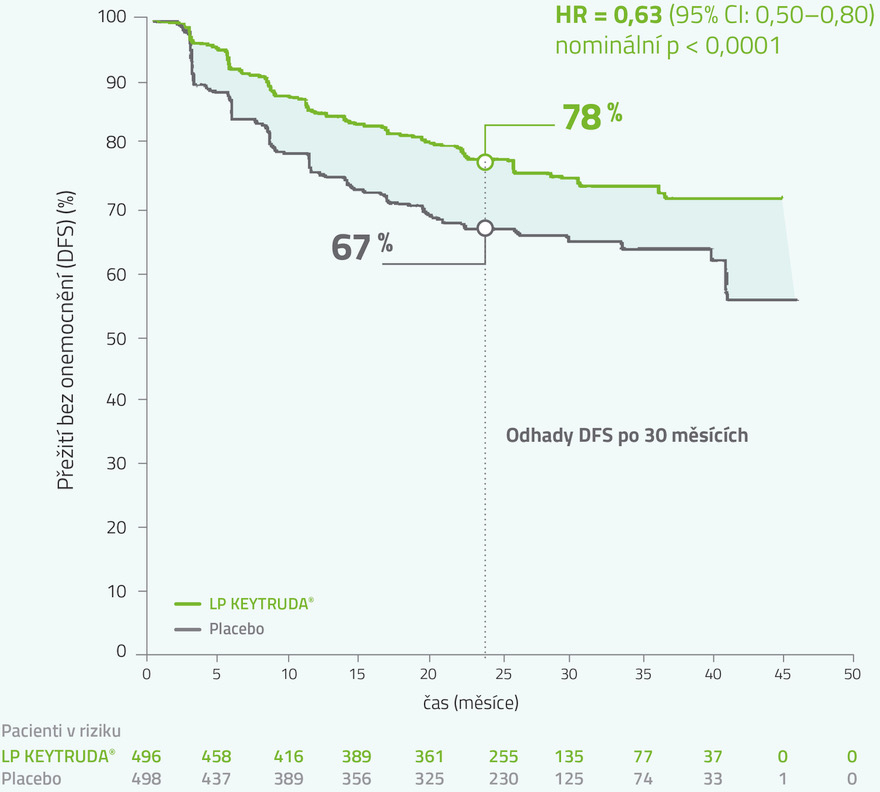
Výsledky klinické studie KEYNOTE-564: následná exploratorní analýza (medián sledování 30 měsíců)
LIMITACE: Pro tuto aktualizovanou analýzu nebylo provedeno žádné formální statistické testování, a proto nelze vyvodit jasné závěry.
HR = 0,63 (95% CI: 0,50–0,80); nominální p<0,0001
Kaplan-Meierovy odhady DFS v klinické studii KEYNOTE-5642,4
Medián času od randomizace do uzavření databáze: 30,1 měsíce (rozmezí: 20,8–47,5 měsíce)
Další informace
Pozorované příhody: 114/496 (23 %) u LP KEYTRUDA® vs. 169/498 (34 %) u placeba.
Medián DFS: nedosažen ani v jedné skupině.
37% redukce rizika rekurence onemocnění, vzniku metastáz nebo smrti v porovnání s placebem.
DFS = přežití bez onemocnění; HR = poměr rizik; CI – interval spolehlivosti.
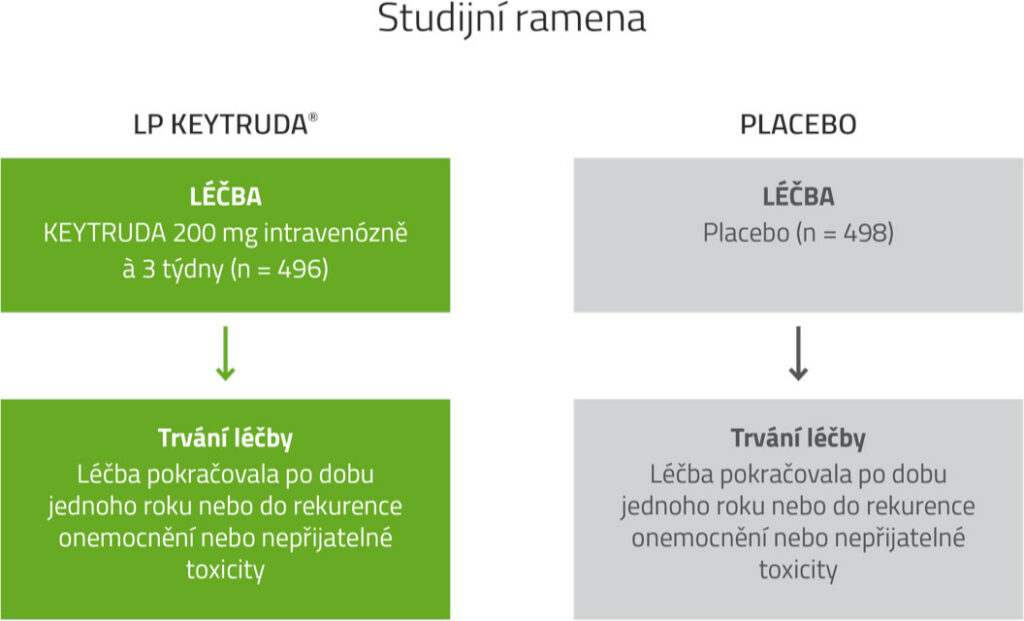
Design klinické studie KEYNOTE-564
Design klinické studie
Multicentrické, randomizované, dvojitě zaslepené, placebem kontrolované klinické hodnocení fáze 3 s 994 pacienty.3
Populace pacientů
Pacienti s RCC se středním až vysokým nebo vysokým rizikem rekurence po nefrektomii, nebo po nefrektomii a resekci metastatických lézí.
Hlavní vylučující kritéria
Pacienti byli z klinického hodnocení vyloučeni, pokud:
- podstoupili předchozí systémovou léčbu pokročilého RCC,
- měli aktivní autoimunitní onemocnění nebo zdravotní stav vyžadující imunosupresi.
Nefrektomie
Pacienti museli podstoupit částečnou nefroprotektivní nebo radikální kompletní nefrektomii (účastníci s M1 bez průkazu onemocnění po chirurgickém výkonu také kompletní resekci solidních, izolovaných metastatických lézí měkkých tkání) s negativními chirurgickými okraji ≥ 4 týdny před screeningem.
Randomizace (1 : 1) (N = 994)
Cílové parametry
Hlavní cílový parametr účinnosti:
- Zkoušejícím hodnocené přežití bez onemocnění (DFS), definované jako čas do rekurence, vzniku metastáz nebo smrti3,e
Další cílový parametr:
- Celkové přežití (OS)
Charakteristiky pacientů
Vstupní charakteristiky pacientů (N = 994)
Všichni pacienti při randomizaci:
- střední až vysoké riziko rekurence: 86 %
- vysoké riziko rekurence: 8 %
- M1 bez průkazu onemocnění po chirurgickém výkonu: 6 %
- Medián věku: 60 let (rozmezí: 25 až 84 let), 33 % ve věku 65 let a starších
- Muži: 71 %
- ECOG PS 0: 85 %; ECOG PS 1: 15 %
- bez postižení lymfatických uzlin (N0): 94 %
- sarkomatoidní znaky: 11 %
- radikální nefrekotmie: 92 %
- částečná nefrektomie: 8 %
eDFS, hodnocené zkoušejícím, je definováno jako čas od randomizace do první dokumentované lokální nebo vzdálené rekurence RCC nebo smrti z jakékoliv příčiny, podle toho, co nastalo jako první.3
ECOG PS = výkonnostní stav dle Eastern Cooperative Oncology Group; M0 = bez metastáz; M1 = vzdálené metastázy; N0 = bez postižení regionálních lymfatických uzlin; N1 = postižení regionálních lymfatických uzlin.
Vybrané NCCN Guidelines® pro management karcinomu ledviny
Pembrolizumab (LP KEYTRUDA®) je jedinou možností imunoterapie v kategorii 2A doporučenou po nefrektomii k adjuvantní léčbě pacientů se5:
- světlobuněčným RCC ve stadiu II a grade 4+ nebo sarkomatoidními znaky
- světlobuněčným RCC ve stadiu III
- světlobuněčným RCC ve stadiu IV po resekci metastáz v průběhu jednoho roku po nefrektomii
Kategorie 2A4 = na základě nižší hladiny důkazů existuje jednotný konsenzus National Comprehensive Cancer Network® (NCCN®), že tato intervence je vhodná.
NCCN neposkytuje žádné záruky jakéhokoli druhu týkající se jejich obsahu, použití nebo aplikace a zříká se jakékoliv odpovědnosti za jejich aplikaci nebo použití jakýmkoliv způsobem.

Bezpečnostní profil
Nežádoucí příhody s incidencí ≥ 10 % v kterékoliv skupině (léčená populace)2

Další informace
Celkem 994 pacientů bylo randomizováno buď k adjuvantní léčbě pembrolizumabem (496 pacientů), nebo k placebu (498 pacientů) (populace se záměrem léčit, ITT). Celkem 488 pacientů dostalo alespoň jednu dávku LP KEYTRUDA® a 496 dostalo alespoň jednu dávku placeba (léčená populace).
- Bezpečnost byla hodnocena u všech pacientů, kteří dostali alespoň jednu dávku LP KEYTRUDA® nebo placeba.
- Medián trvání expozice LP KEYTRUDA® byl 11,1 měsíce (rozmezí: 0,0 až 14,3 měsíce) vs. 11,1 měsíce (rozmezí 0,0 až 15,4 měsíce) u placeba.
- V léčené populaci se nežádoucí příhoda jakéhokoliv stupně a jakékoliv příčiny vyskytla u 96,3 % pacientů léčených LP KEYTRUDA® vs. 91,1 % pacientů dostávajících placebo.
- Celkem u 32,4 % pacientů léčených LP KEYTRUDA® a 17,7 % pacientů dostávajících placebo se vyskytla nežádoucí příhoda stupně 3 až 5.
- U 79,1 % pacientů léčených LP KEYTRUDA® se vyskytly nežádoucí příhody související s léčbou (z nichž 18,9 % bylo stupně 3–5) vs. 53,4 % ve skupině s placebem (1,2 % stupně 3–5).
- V léčené populaci ukončilo léčbu z důvodu nežádoucí příhody 20,7 % pacientů léčených LP KEYTRUDA® a 2,0 % pacientů na placebu.
VYBRANÉ NEŽÁDOUCÍ ÚČINKY1
Závažné a fatální imunitně zprostředkované nežádoucí účinky
LP KEYTRUDA® je monoklonální protilátka patřící do skupiny léčiv, které se vážou buď na receptor programované buněčné smrti PD-1 (programmed cell death-1) nebo jeho ligand PD-L1 a způsobují tak zablokování signální cesty PD-1/PD-L1. To vede ke zrušení inhibice imunitní odpovědi, což může potenciálně způsobit narušení periferní tolerance a indukovat imunitně zprostředkované nežádoucí účinky. Imunitně zprostředkované nežádoucí účinky, které mohou být závažné nebo fatální, mohou postihnout kterýkoliv orgánový systém nebo tkáň, mohou se vyskytnout ve více orgánových systémech současně a mohou se objevit kdykoliv po zahájení léčby nebo po jejím ukončení. Důležité imunitně zprostředkované nežádoucí účinky, které jsou zde vyjmenovány, nemusí zahrnovat veškeré možné závažné a fatální imunitně zprostředkované nežádoucí účinky.
Pečlivě pacienty sledujte stran výskytu příznaků a známek, které by mohly být klinickou manifestací imunitně zprostředkovaných nežádoucích účinků. Jejich časná identifikace a léčba je pro bezpečné užití léčby cílené na PD-1/PD-L1 zásadní. Před zahájením léčby a pak pravidelně v jejím průběhu mají být sledovány hladiny jaterních enzymů, kreatininu a funkce štítné žlázy. Při podezření na imunitně zprostředkované nežádoucí účinky má být zajištěno odpovídající vyšetření, aby se vyloučily jiné příčiny, včetně infekce. Dle situace může být vyžadováno zahájení okamžité lékařské intervence, včetně konzultace se specialisty.
V závislosti na závažnosti imunitně zprostředkovaného nežádoucího účinku má být LP KEYTRUDA® dočasně nebo trvale vysazen. Obecně, pokud je nutné léčbu LP KEYTRUDA® přerušit nebo ji vysadit, mají být podávány systémové kortikosteroidy (1 až 2 mg/kg/den prednisonu nebo jeho ekvivalentu), dokud nedojde ke zlepšení na stupeň 0 nebo 1. Jakmile dojde ke zlepšení nežádoucího účinku na stupeň 0 nebo 1, má být zahájeno postupné vysazování kortikosteroidu trvající minimálně 1 měsíc. U pacientů, jejichž nežádoucí účinky nejsou dostatečně kontrolovány léčbou kortikosteroidy, má být zváženo podání jiných systémových imunosupresiv.
Podmínky úhrady
Pembrolizumab je hrazen v monoterapii k adjuvantní léčbě dospělých pacientů se světlobuněčným renálním karcinomem se zvýšeným rizikem rekurence po nefrektomii (kompletní i parciální), nebo po nefrektomii a resekci metastatických lézí. Pacienti mají výkonnostní stav 0-1 dle ECOG. Léčba je hrazena do rekurence onemocnění nebo nepřijatelné toxicity, a to maximálně po dobu 12 měsíců od jejího zahájení.1,6
Reference:
1. SPC LP Keytruda® na www.sukl.cz.
2. Choueiri TK, Tomczak P, Park SH, et al. Pembrolizumab as Post Nephrectomy Adjuvant Therapy for Patients with Renal Cell Carcinoma:
Results from 30-month Follow-up of KEYNOTE-564. Presented at ASCO-GU Annual Meeting, 17-19 February 2022, Online. Abstract #290.
3. Choueiri TK, Tomczak P, Park SH, et al; for the KEYNOTE-564 investigators. Adjuvant pembrolizumab after nephrectomy in renal-cell carcinoma. N Engl J Med. 2021;385(8):683–694.
4. Data available on request from Merck, Professional Services-DAP, WP1-27, PO Box 4, West Point, PA 19486-0004. Please specify information package US-JRC-00196.
5. Reference se souhlasem NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines®) for Kidney Cancer v4.2022. © National Comprehensive Cancer Network, Inc. 2022. All rights reserved. Navštíveno 18. března 2022. Nejnovější a úplnou verzi doporučených postupů lze najít na NCCN.org.
6. Rozhodnutí o úhradě LP Keytruda® v indikaci adjuvantní léčby renálního karcinomu, Sp. zn.: SUKLS211710/2022, vyvěšeno dne 28. 4. 2023.

První linie léčby pokročilého renálního karcinomu
Indikace
LP KEYTRUDA® je v kombinaci s lenvatinibem indikován v první linii k léčbě pokročilého renálního karcinomu u dospělých.2
Mechanismy účinku přípravků KEYTRUDA® a KISPLYX®3,4
Antiangiogenní účinek přípravku KISPLYX® (multi-TKI) v kombinaci s imunostimulačním účinkem přípravku KEYTRUDA® (anti-PD-1) vede v nádorovém mikroprostředí k masivnější aktivaci T-lymfocytů, což pomáhá překonat primární a získanou rezistenci vůči imunoterapii a může zlepšit odpověď nádoru v porovnání s léčbou kterýmkoliv z těchto dvou přípravků samostatně.
Mechanismus účinku přípravku KEYTRUDA®
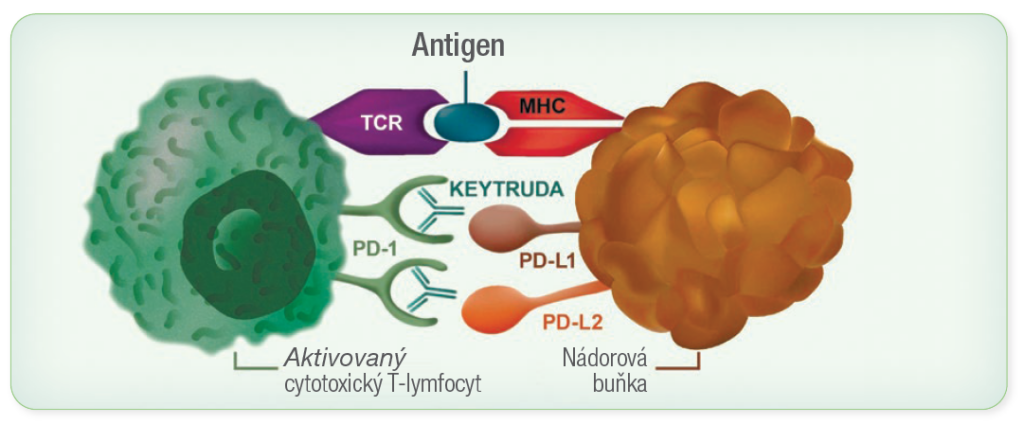
- KEYTRUDA® je selektivní humanizovaná monoklonální protilátka, která blokuje interakci mezi PD-1 a jeho ligandy PD-L1 a PD-L2.
- Inhibicí vazby ligandů na receptor PD-1 přípravku KEYTRUDA® reaktivuje nádorově specifické cytotoxické T-lymfocyty v nádorovém mikroprostředí a podporuje tak protinádorovou imunitu.3
- Kromě účinku na samotný nádor ale mohou být ovlivněny i normální zdravé buňky.3
Mechanismus účinku přípravku KISPLYX®
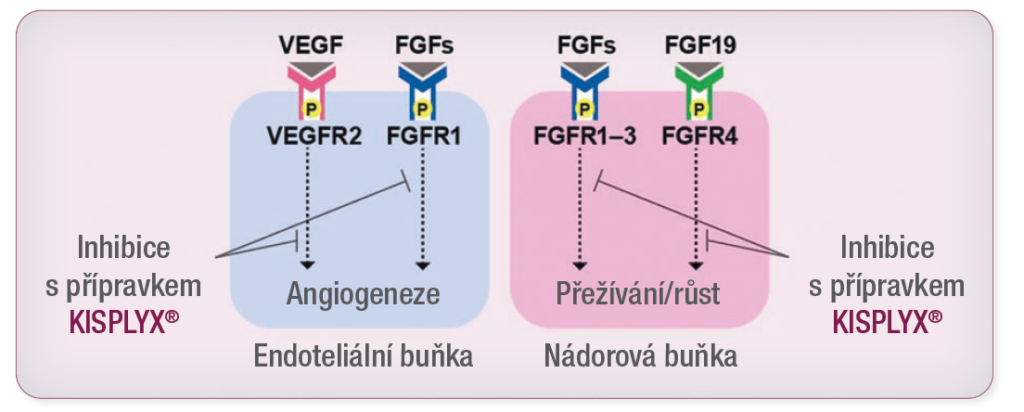
- Přípravek KISPLYX® je kinázový inhibitor inhibující kinázové aktivity receptorů vaskulárního endoteliálního růstového faktoru VEGFR1 (FLT1), VEGFR2 (KDR) a VEGFR3 (FLT4).
- Přípravek KISPLYX® inhibuje i další kinázy, které se kromě jejich normálních buněčných funkcí podílejí na patogenní angiogenezi, růstu a progresi nádoru, kam patří receptory fibroblastového růstového faktoru FGFR1, 2, 3 a 4, receptor alfa destičkového růstového faktoru (PDGFRa), KIT a RET.
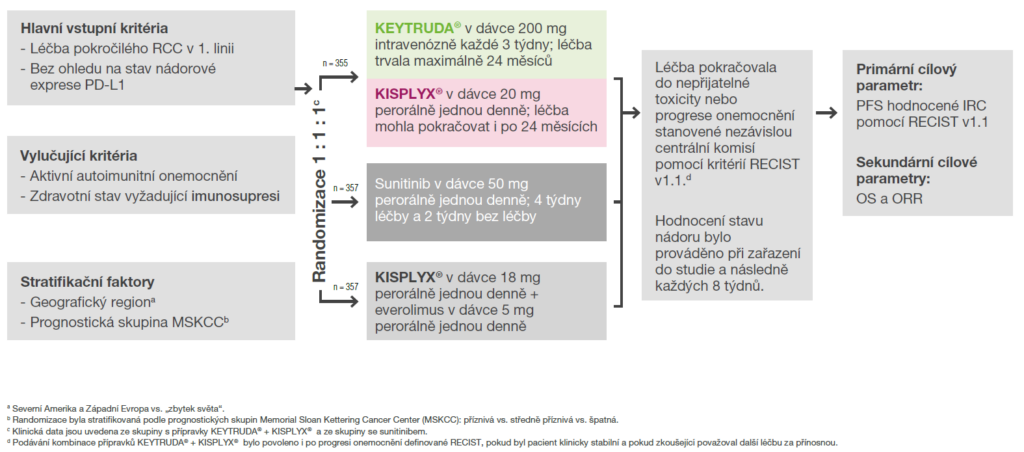
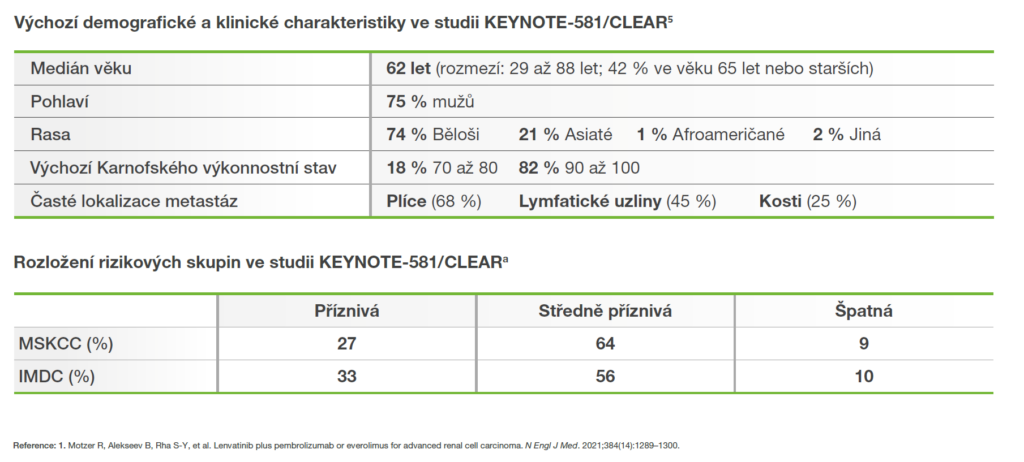
Design registrační studie KEYNOTE-581/CLEAR5,6
Studie KEYNOTE-581/CLEAR: multicentrická, randomizovaná, otevřená studie zahrnující 1 069 pacientů.5,6
Výsledky klinické studie KEYNOTE-581/CLEAR
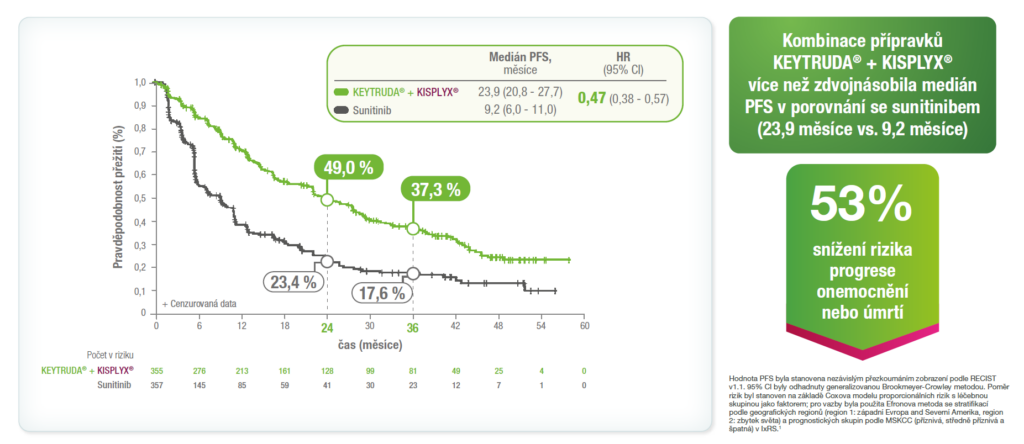
Výsledky PFS z předem specifikované finální analýzy OS ze studie KEYNOTE-581/CLEAR1
Medián doby sledování (IQR) pro PFS byl 39,2 měsíce (22,1–48,5) ve skupině léčené kombinací přípravků KEYTRUDA® + KISPLYX® a 20,6 měsíce (5,5–41,2) ve skupině léčené sunitinibem.1
Předem specifikovaná finální analýza OS byla provedena po 23 měsících dalšího sledování od primární analýzy.1
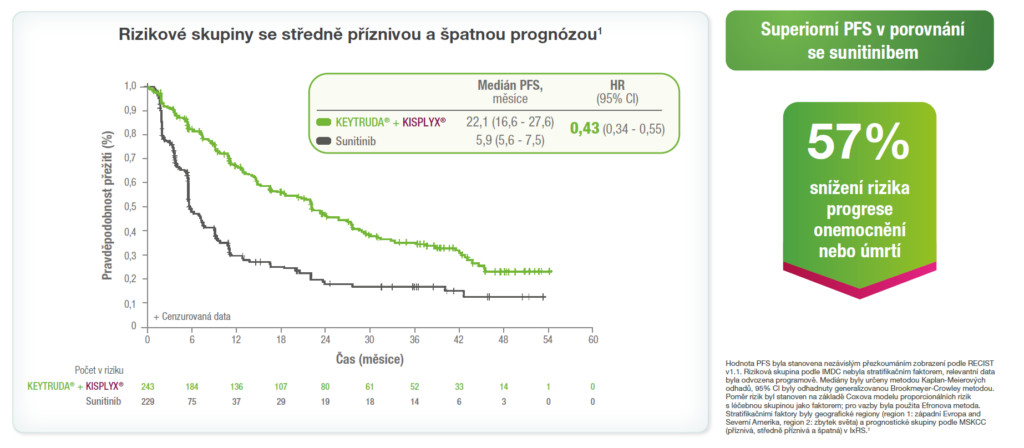
Analýzy PFS v rizikových podskupinách podle IMDC1
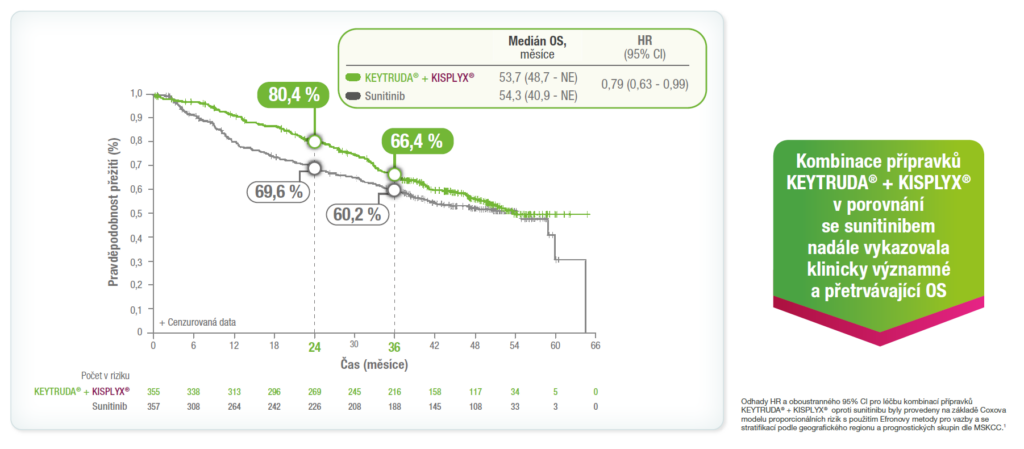
Předem specifikovaná finální analýza OS ze studie KEYNOTE-581/CLEAR1
Při mediánu doby sledování OS (IQR) 49,8 měsíce (41,4–53,1) ve skupině KEYTRUDA® + KISPLYX® a 49,4 měsíce (41,6–52,8) ve skupině sunitinibu se vyskytlo 308 cílových příhod OS (KEYTRUDA® + KISPLYX®, 149 příhod; sunitinib, 159 příhod).5
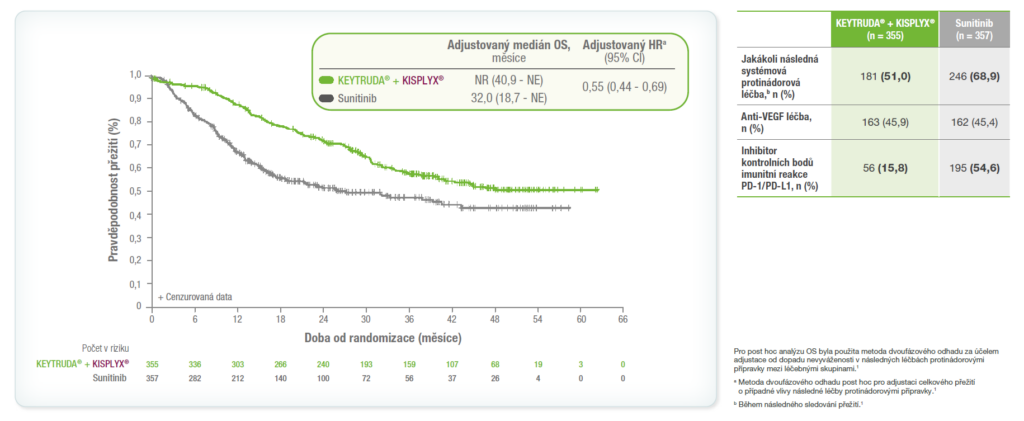
Finální analýza OS adjustovaná o následné léčby protinádorovými léčivými přípravky1
Méně pacientů v rameni KEYTRUDA® + KISPLYX® (15,8 %) dostalo jako následnou protinádorovou léčbu inhibitory kontrolních bodů PD-1/PD-L1 ve srovnání v rameni se sunitinibem (54,6 %).1
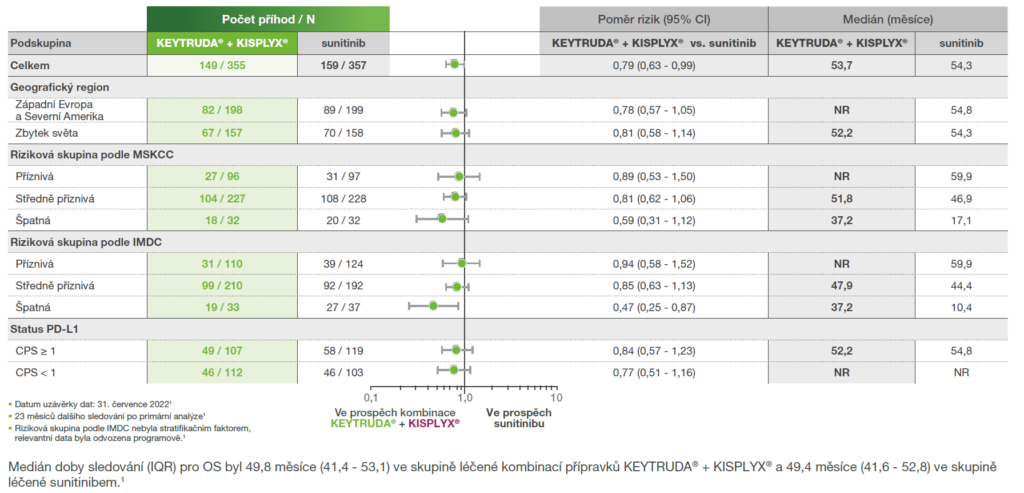
Analýza podskupin z předem specifikované finální analýzy OS ze studie KEYNOTE-581/CLEAR1
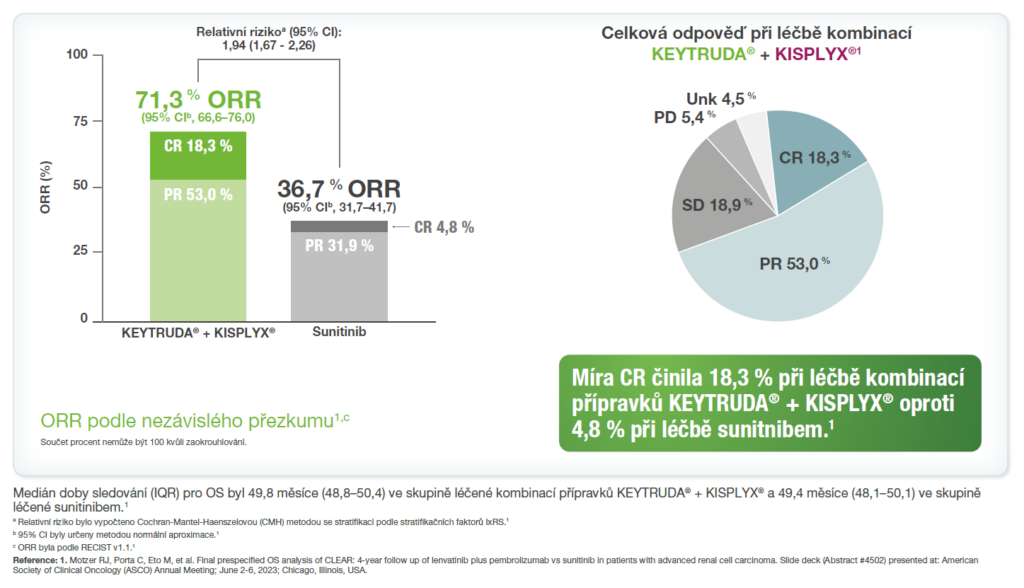
Téměř 4x více pacientů dosáhlo kompletní odpovědi s kombinovanou léčbou přípravků KEYTRUDA® + KISPLAX® vs. sunitinib1
Míry odpovědi z předem specifikované finální analýzy OS ze studie KEYNOTE-581/CLEAR.1
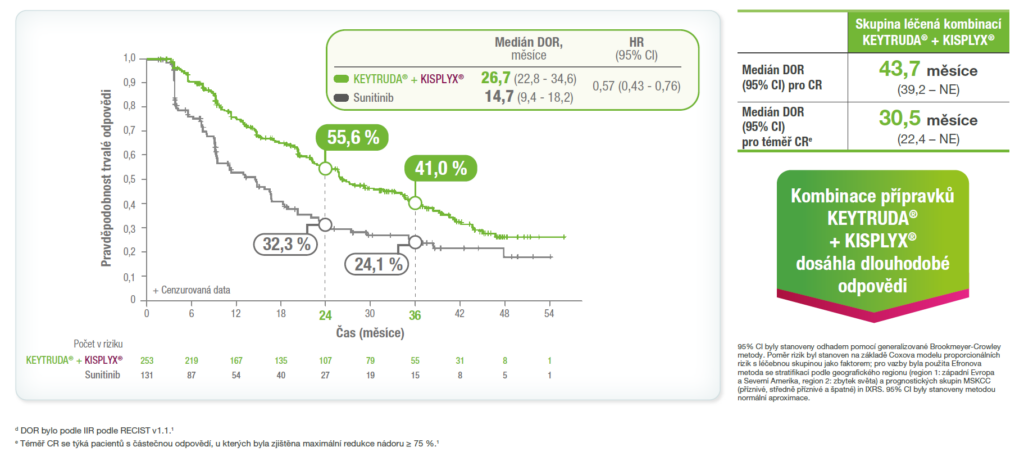
Medián trvání odpovědi (DOR) byl 26,7 měsíce v rameni KEYTRUDA® + KISPLYX® vs 14,7 měsíce v rameni se sunitinibem1,d
Kombinace přípravků KEYTRUDA® + KISPLYX®: doporučené dávkování a způsob podání při léčbě pokročilého renálního karcinomu


Bezpečnostní profil
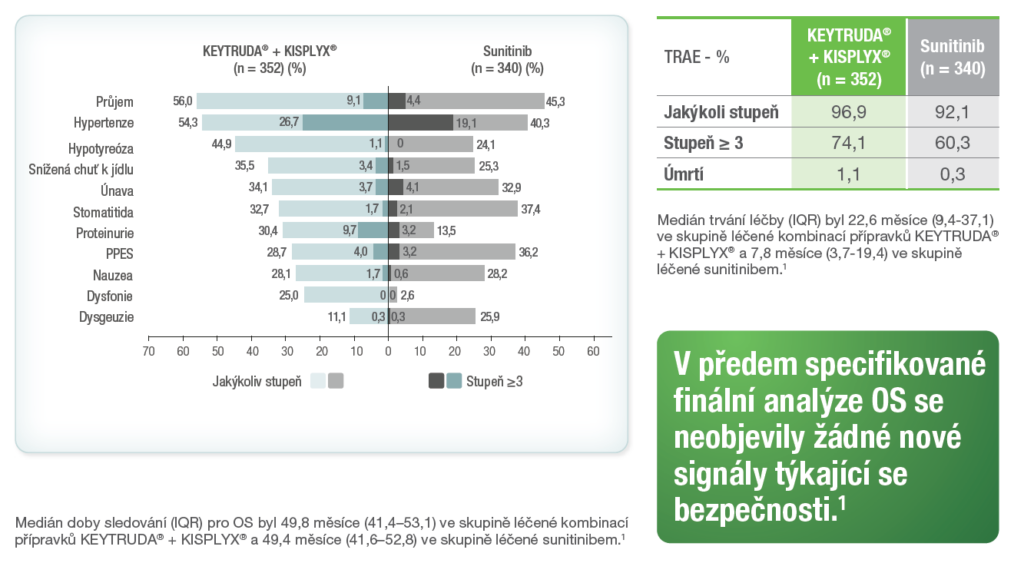
Nežádoucí příhody související s léčbou (TRAE) u nejméně 25 % pacientů v jakékoli léčebné skupině ve finální analýze OS ze studie KEYNOTE-581/CLEAR1
Podmínky úhrady8
Lenvatinib je v kombinaci s pembrolizumabem hrazen v první linii u dospělých pacientů s pokročilým, inoperabilním nebo metastatickým světlobuněčným renálním karcinomem se střední nebo špatnou prognózou (dle kritérií IMDC) při splnění následujících podmínek:
a) pacient má výkonnostní stav 0-1 dle ECOG;
b) pacient je indikován (s ohledem na stav a komorbidity) k léčbě inhibitory kontrolních bodů;
c) pacient nevykazuje přítomnost symptomatických mozkových metastáz anebo mozkové metastázy jsou adekvátně léčené;
d) pacient není dlouhodobě léčen systémovými kortikosteroidy v dávce prednisonu nad 10 mg denně (či odpovídajícím ekvivalentem) nebo jinou imunosupresivní léčbou;
e) pacient nemá diagnostikované závažné aktivní systémové autoimunitní onemocnění s výjimkou následujících onemocnění: diabetes mellitus I. typu, autoimunitní zánět štítné žlázy, kožní autoimunitní onemocnění (např. psoriáza, atopický ekzém, ložisková alopecie, vitiligo);
f) pacient má přijatelnou funkci ledvin a jater (hladina kreatininu je menší nebo rovna 3x ULN, hladina bilirubinu menší nebo rovna 1,5x ULN, u pacientů s Gilbertovým syndromem menší nebo rovna 3x ULN, hladina AST a ALT menší nebo rovna 3x ULN, v případě přítomnosti jaterních metastáz menší nebo rovna 5x ULN), a současně uspokojivé hodnoty krevního obrazu (hladina hemoglobinu větší nebo rovna 90 g/l, počet leukocytů větší nebo roven 2,5 x 10(index)9/l, počet neutrofilů větší nebo roven 1,5 x 109/l, počet trombocytů větší nebo roven 100 x 109/l). Léčba je hrazena do potvrzení progrese onemocnění, verifikované opakovaným radiologickým vyšetřením v odstupu 4-8 týdnů z důvodu odlišného mechanismu účinku imuno-onkologické terapie. V případě předčasného ukončení léčby kterýmkoliv z léčivých přípravků z důvodu jeho toxicity je nadále hrazena terapie druhým léčivem dle výše uvedených podmínek. Léčba pembrolizumabem je z prostředků veřejného zdravotního pojištění hrazena maximálně po dobu 24 měsíců.
Reference
1. Motzer RJ, Porta C, Eto M, et al. Final prespecified OS analysis of CLEAR: 4-year follow up of lenvatinib plus pembrolizumab vs sunitinib in patients with advanced renal cell carcinoma. Slide deck (Abstract #4502) presented at: American Society of Clinical Oncology (ASCO) Annual Meeting; June 2-6, 2023; Chicago, Illinois, USA.
2. SPC přípravku KEYTRUDA® na www.sukl.cz.
3. Pardoll DM. The blockade of immune checkpoints in cancer immunotherapy. Nat Rev Cancer. 2012;12(4):252–264. doi:10.1038/nrc3239.
4. Kudo M. Lenvatinib may drastically change the treatment landscape of hepatocellular carcinoma. Liver Cancer. 2018;7(1):1–19.
5. Motzer R, Alekseev B, Rha S-Y, et al. Lenvatinib plus pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med. 2021;384(14):1289–1300.
6. Motzer R, Alekseev B, Rha S-Y, et al. Supplementary Appendix to: Lenvatinib plus
pembrolizumab or everolimus for advanced renal cell carcinoma. N Engl J Med. 2021;384(14):1289–1300. doi:10.1056/NEJMoa2035716
7. SPC přípravku KISPLYX® na www.sukl.cz.
8. Rozhodnutí o úhradě LP Kisplyx® v indikaci pokročilého, inoperabilního nebo metastatického světlobuněčného renálního karcinomu se střední nebo špatnou prognózou, Sp. zn. SUKLS114185/2022, vyvěšeno dne: 12. 7. 2023.
OMEZENÍ: Pro tuto předem specifikovanou finální analýzu nebylo provedeno formální statistické testování, nelze tudíž vyvozovat závěry.
CI = interval spolehlivosti; CPS = kombinované pozitivní skóre; CR = kompletní odpověď; FGF = fibroblastový růstový faktor; FGFR = receptor fibroblastového růstového faktoru; FLT = tyrozinkináza 1 spojená s FMS; HR = poměr rizik; IIR = zkoušejícím zahájené zkoumání; IMDC = International Metastatic Renal Cell Carcinoma Database Consortium; IRC = nezávislé centrální hodnocení; IQR = mezikvartilové rozpětí; IxRS = interaktivní hlasový/webový systém odezvy; KDR = receptor kinázové inzertní domény; KIT = tyrozinkinázový receptor typu III; MHC = hlavní histokompatibilní komplex; MSKCC = Memorial Sloan Kettering Cancer Center; NE = nebylo určeno; NR = nebylo dosaženo; OS = celkové přežití; ORR = míra objektivní odpovědi; PD = progresivní onemocnění; PR = částečná odpověď; PD-1 = receptor programované buněčné smrti 1; PD-L1 = ligand receptoru programované buněčné smrti 1; PD-L2 = ligand receptoru programované buněčné smrti 2; PDGFR = receptor destičkového růstového faktoru; PFS = přežití bez progrese; PPES = syndrom palmární-plantární erytrodysestezie; RCC = renální karcinom; RECIST = kritéria hodnocení léčebné odpovědi u solidních nádorů; RECIST v1.1 = kritéria hodnocení léčebné odpovědi u solidních nádorů verze 1.1; RET = tyrozinkinázový receptor pro neurotrofický růstový faktor odvozený od gliálních buněk; SD = stabilní onemocnění; TCR = T-lymfocytární receptor; TKI = inhibitor tyrozinkinázy; Unk = stabilní onemocnění.; VEGF = vaskulární endoteliální růstový faktor; VEGFR = receptor vaskulárního endoteliálního růstového faktoru
CZ-KEY-00872 (4.0), duben 2024









