Indikace
Karcinom děložního hrdla
Terapeutické indikace
Přípravek KEYTRUDA® je v kombinaci s chemoterapií s nebo bez bevacizumabu indikován k léčbě perzistentního, recidivujícího nebo metastazujícího karcinomu děložního hrdla u dospělých, jejichž nádory exprimují PD-L1 s CPS ≥ 1.1
Léčba pacientů s perzistentním, recidivujícím nebo metastazujícím karcinomem děložního hrdla
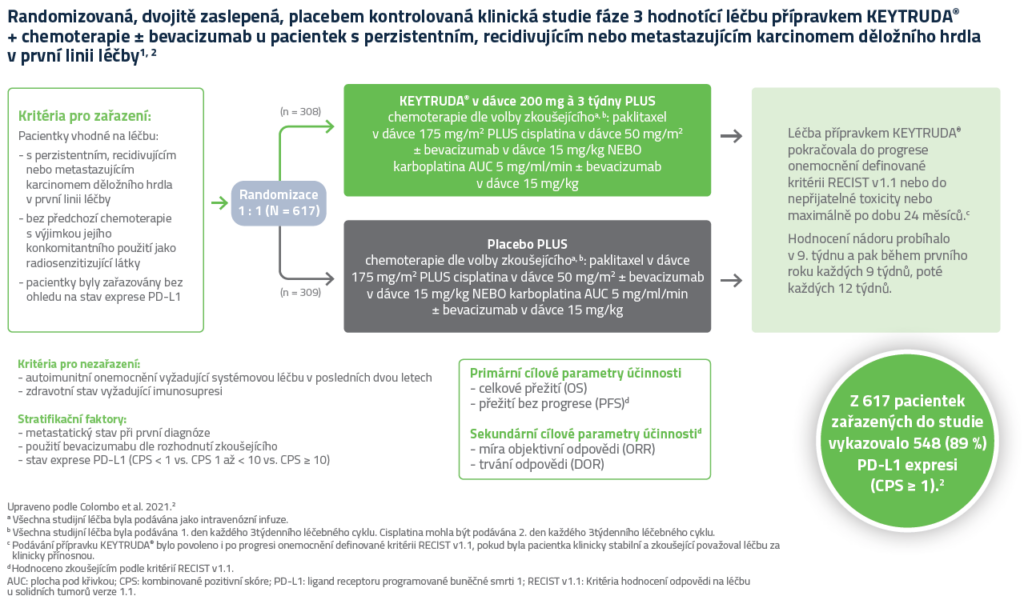
Design klinické studie KEYNOTE-8261,2
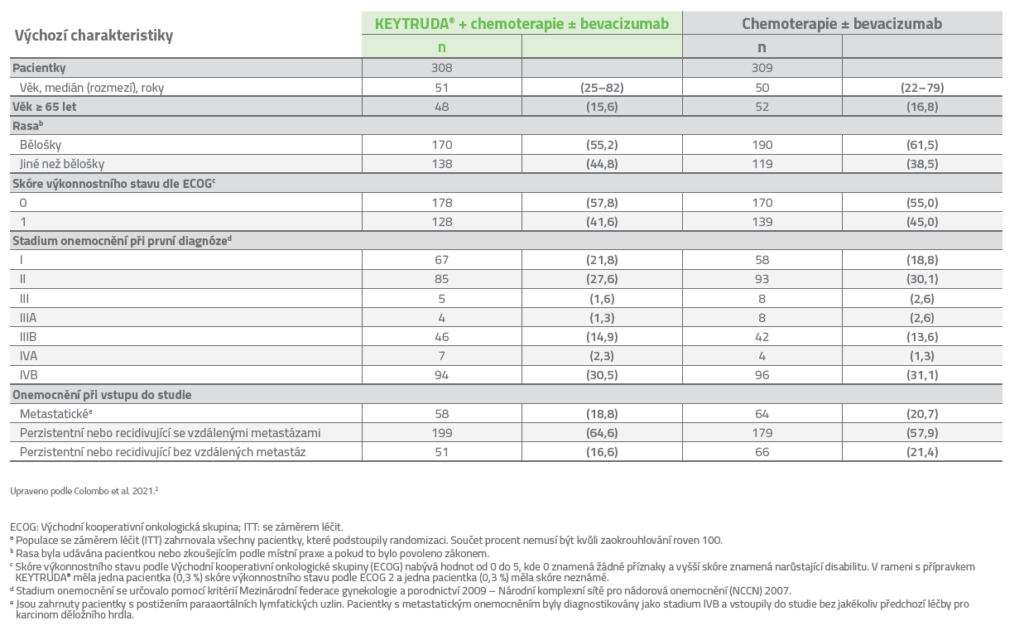
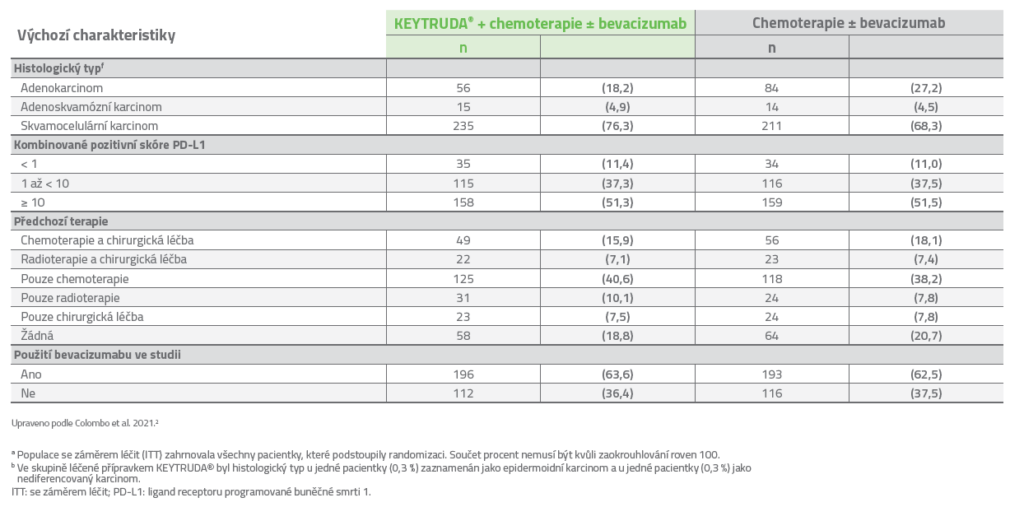
Charakteristiky pacientů v ITT populaci2
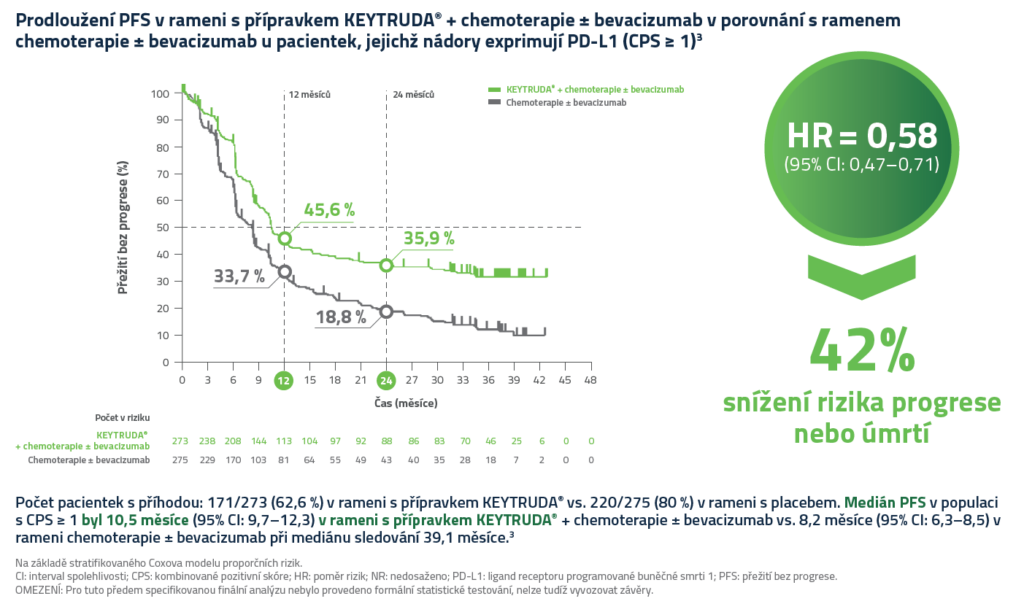
Přežití bez progrese v populaci pacientů s expresí PD-L1 (CPS≥1)3
Celkové přežití v populaci pacientů s expresí PD-L1 (CPS≥1)4
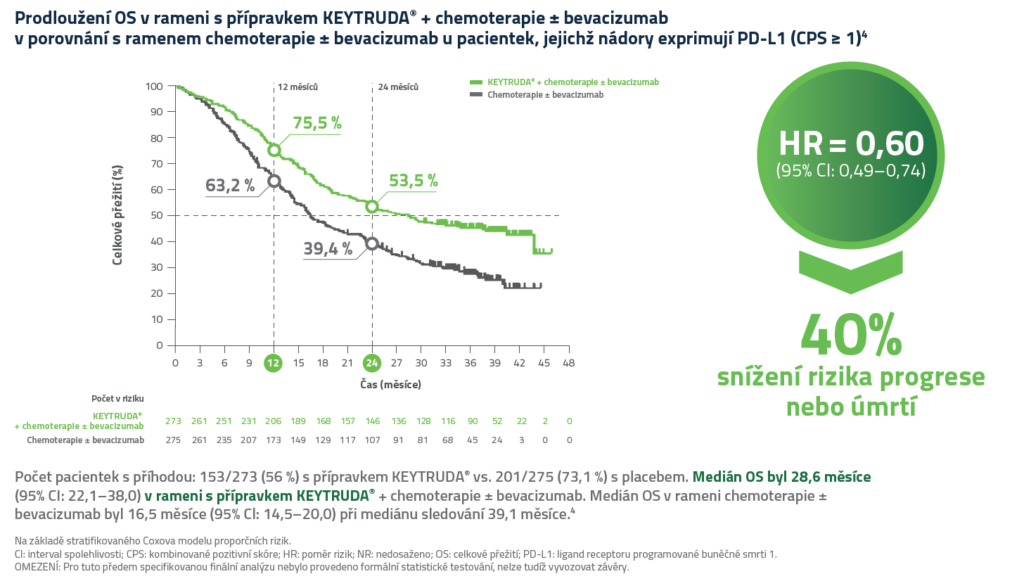
Míra objektivní odpovědi (ORR) a trvání odpovědi (DOR)5
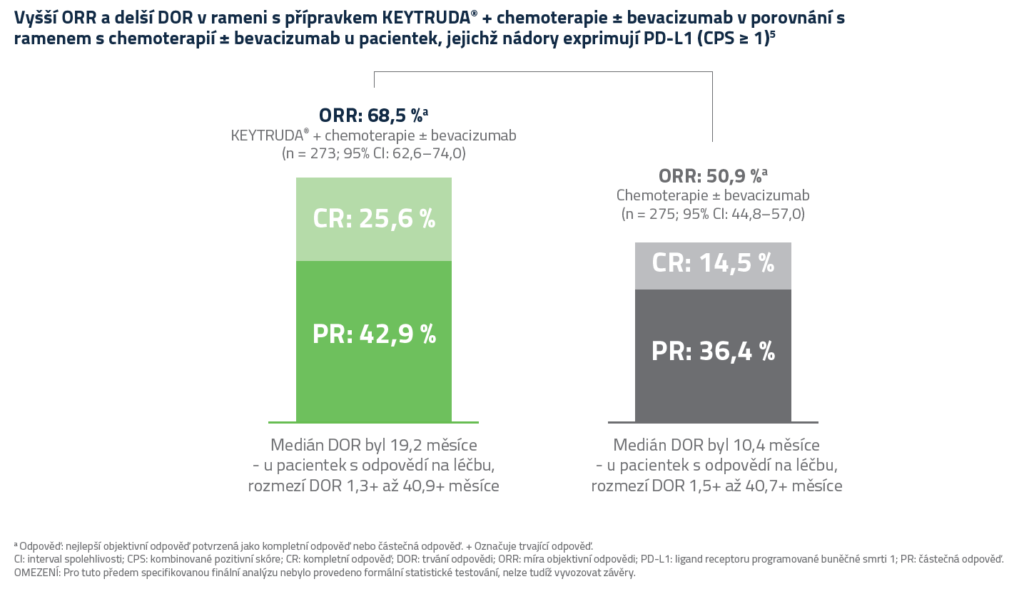
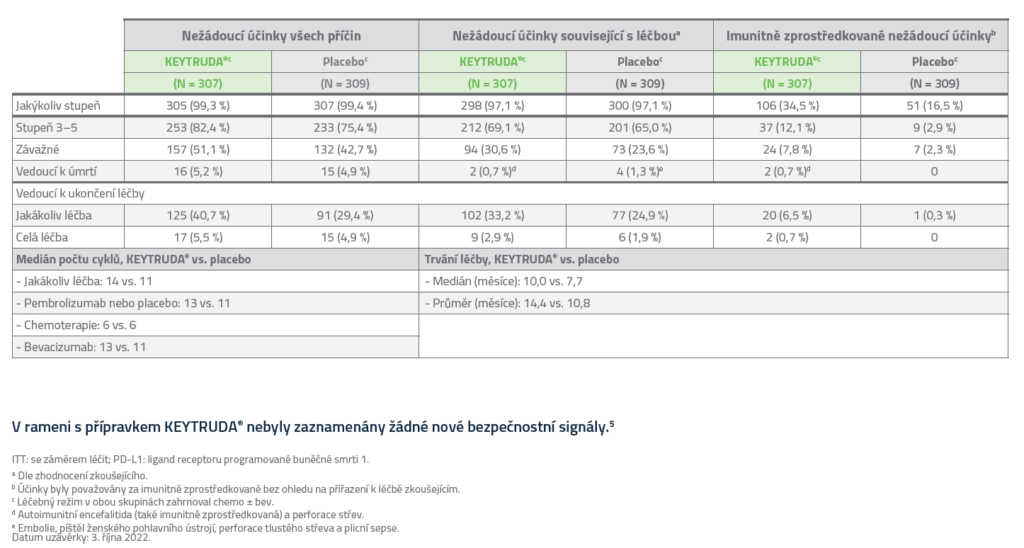
Bezpečnostní profil dle studie KEYNOTE-826
Nežádoucí příhody s výskytem ≥ 20 %5
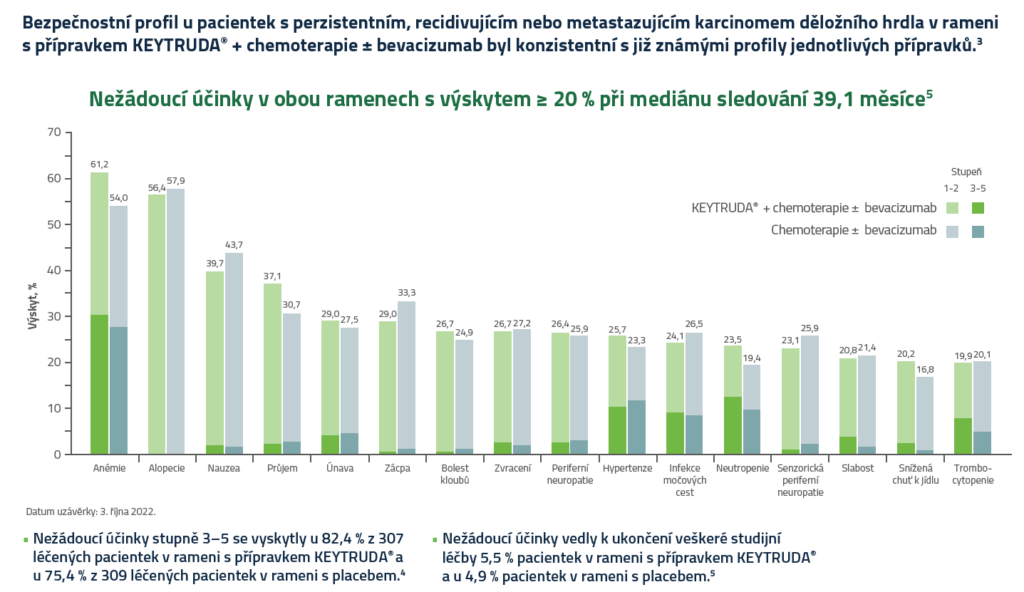
Imunitně zprostředkované nežádoucí příhody s výskytem ≥ 2 %5
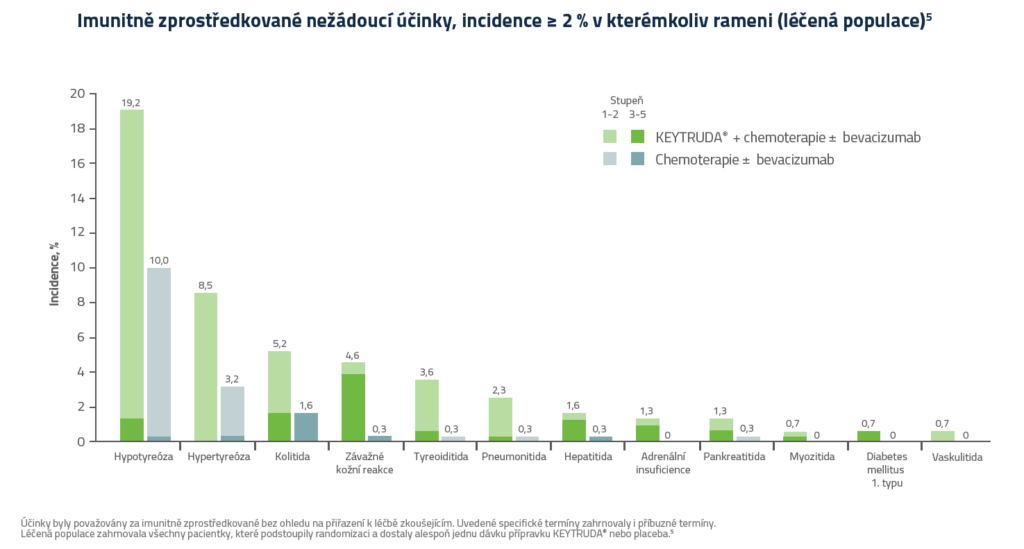
Nežádoucí příhody a expozice5
Reference
1. SPC přípravku KEYTRUDA® na www.sukl.cz.
2. Colombo N, et al. Pembrolizumab for persistent, recurrent, or metastatic cervical cancer. N Engl J Med. 2021;385:1856-67.
3. Lorusso et al. Pembrolizumab + Chemotherapy for First-Line Treatment of Patients with Persistent, Recurrent, or Metastatic Cervical Cancer: Final Overall Survival Results and Bevacizumab Subgroup Analysis of KEYNOTE-826. Presented at ESGO. 2023.
4. Monk et al., First-Line Pembrolizumab + Chemotherapy Versus Placebo + Chemotherapy for Persistent, Recurrent, or Metastatic Cervical Cancer: Final Overall Survival Results of KEYNOTE-826. J Clin Oncol. 2023;00:1-7.
5. Monk BJ, Colombo N, Tewari KS, et al. Pembrolizumab + chemotherapy versus placebo + chemotherapy for persistent, recurrent, or metastatic cervical cancer: final overall survival results of KEYNOTE-826. Presented at: American Society of Clinical Oncology (ASCO) Annual Meeting. 2023.
CC = karcinom děložního hrdla; CPS= kombinované pozitivní skóre; CI = interval spolehlivosti; HR= poměr rizik; nab-paklitaxel = paklitaxel ve vazbě na protein; PD-L1 = ligand receptoru programované buněčné smrti 1.
Podmínky úhrady1
Pembrolizumab je hrazen v kombinaci s chemoterapií (zahrnující platinový derivát + paklitaxel) s nebo bez bevacizumabu v léčbě perzistentního, recidivujícího nebo metastazujícího karcinomu děložního hrdla s expresí PD-L1 s CPS více nebo rovno 1 u dospělých pacientek s výkonnostním stavem 0-1 dle ECOG, které nebyly dříve léčeny systémovou chemoterapií pro rekurentní nebo metastatické onemocnění a současně nejsou vhodné ke kurativní léčbě (operační léčba a/nebo radioterapie). Kombinace pembrolizumabu se samotnou chemoterapií je hrazena pouze pacientkám nevhodným k léčbě bevacizumabem.
Léčba pembrolizumabem se ukončuje po vyčerpání maxima 35 cyklů terapie nebo při zjištění progrese verifikované opakovaným radiologickým vyšetřením v odstupu 4–8 týdnů z důvodu odlišného mechanismu účinku imuno-onkologické terapie či při netoleranci léčby pembrolizumabem. V případě nutnosti ukončení léčby jedné složky z podávané kombinace z důvodu její netolerance je možné pokračovat v podávání ostatních léčiv.

Reference:
1. Podmínky úhrady přípravku KEYTRUDA® v indikaci perzistentního, recidivujícího nebo metastazujícího karcinomu děložního hrdla na www.sukl.cz. Datum přístupu 13. 9. 2023.
CZ-KEY-00961 (3.0), datum přípravy: leden 2024.
Zkrácená informace o léčivém přípravku KEYTRUDA® k dispozici ZDE.









