Indikace
TNBC
Triple-negativní karcinom prsu
Terapeutické indikace
Přípravek KEYTRUDA® je v kombinaci s chemoterapií v neoadjuvantní léčbě a následně po chirurgické léčbě v monoterapii v adjuvantní léčbě indikován k léčbě dospělých s lokálně pokročilým nebo časným stadiem triple-negativního karcinomu prsu s vysokým rizikem recidivy.1
Přípravek KEYTRUDA® je v kombinaci s chemoterapií indikován k léčbě lokálně rekurentního neresekovatelného nebo metastazujícího triple-negativního karcinomu prsu u dospělých, jejichž nádory exprimují PD-L1 s CPS≥10 a kteří dosud nebyli léčeni chemoterapií pro metastatické onemocnění.1
Léčba pacientů s časným triple-negativním karcinomem prsu s vysokým rizikem recidivy
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Design klinické studie KEYNOTE-5222,3
Randomizované, multicentrické, dvojitě zaslepené, placebem kontrolované klinické hodnocení fáze 3 u 1 174 pacientů s nově diagnostikovaným, dříve neléčeným časným stádiem TNBC s vysokým rizikem recidivy.
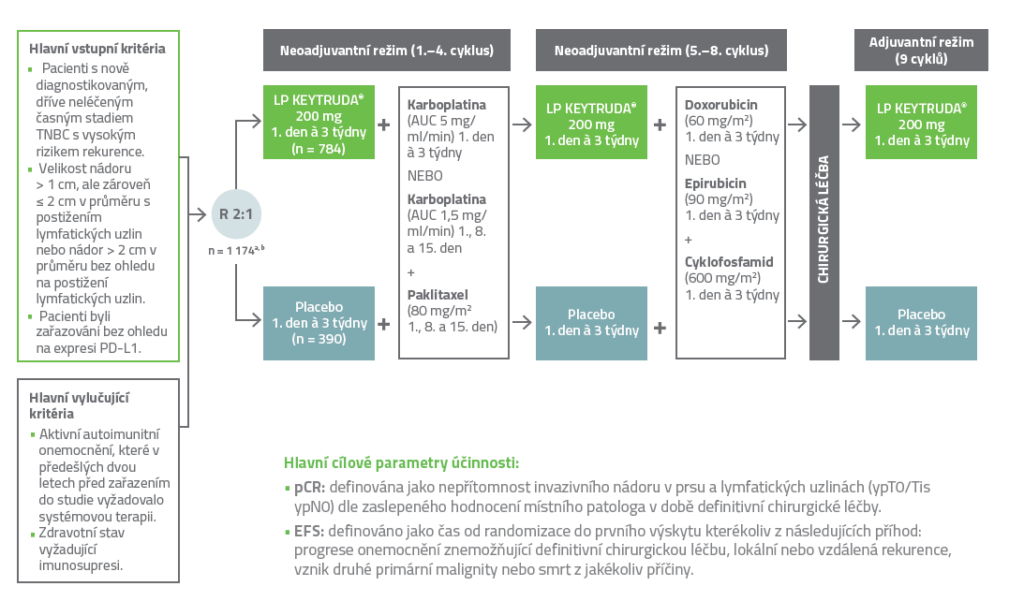
a Randomizace byla stratifikována podle stavu lymfatických uzlin (pozitivní vs. negativní), velikosti nádoru (T1/T2 vs. T3/T4) a výběru dávkování karboplatiny (každé tři týdny vs. každý týden).
b Všechna studijní medikace byla podávána intravenózně.
Charakteristiky pacientů2,3*
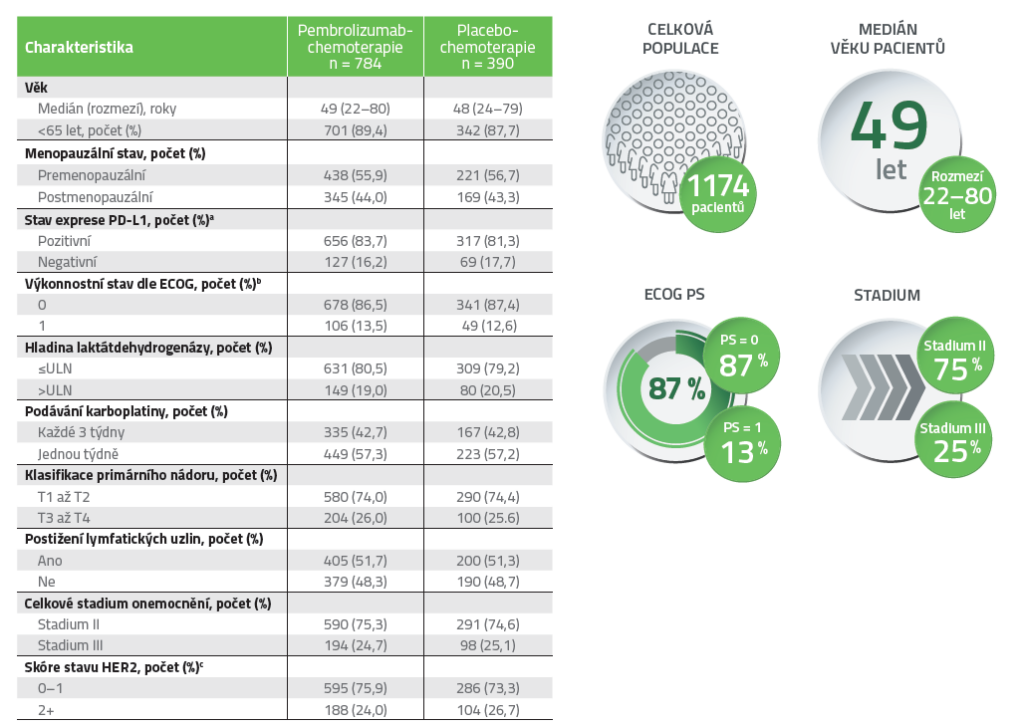
* Uvedené údaje vycházejí z populace se záměrem léčit (ITT). Z důvodu zaokrouhlování a chybějících dat nemusí být součet procentuálních hodnot roven 100. ULN znamená horní hranici normálního rozmezí.
a Pozitivita ligandu receptoru programované smrti 1 (PD-L1) byla definována jako kombinované pozitivní skóre 1 nebo vyšší. Kombinované pozitivní skóre PD-L1 bylo definováno jako počet PD-L1-pozitivních buněk (nádorové buňky, lymfocyty a makrofágy) dělený celkovým počtem nádorových buněk a vynásobený 100.
b Skóre výkonnostního stavu podle Eastern Cooperative Oncology Group (ECOG) nabývá hodnot od 0 do 5, přičemž 0 znamená nepřítomnost žádných příznaků a vyšší skóre znamená větší disabilitu.
c Nádory s expresí receptoru pro lidský epidermální růstový faktor 2 (HER2) rovnou 0 nebo 1 podle imunohistochemické analýzy byly negativní. Všechny nádory s expresí HER2 2+ podle imunohistochemické analýzy byly negativní pro amplifikaci HER2 in situ hybridizací.
Výsledky klinické studie KEYNOTE-522
Míra pCR2
64,8 % pacientek léčených kombinací přípravku KEYTRUDA® + chemoterapie dosáhlo kompletní patologické odpovědi.2
KEYNOTE-522: V předem specifikované analýze při mediánu sledování 15,5 měsíce bylo prokázáno statisticky významné zlepšení v míře pCRa s přípravkem KEYTRUDA® plus chemoterapie oproti placebu plus chemoterapie.2
• pCR byla definována jako nepřítomnost invazivního nádoru v prsu a lymfatických uzlinách (ypT0/Tis ypN0) dle zaslepeného hodnocení místního patologa v době definitivní chirurgické léčby.
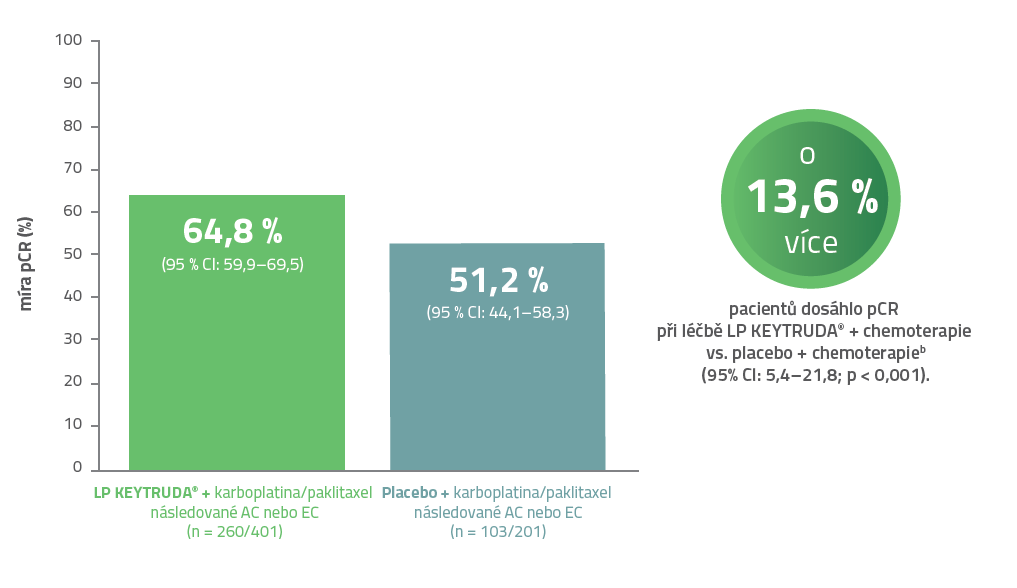
a Na základě předem specifikované průběžné analýzy pCR (porovnáno s hladinou významnosti 0,003).
b Na základě Miettinenovy a Nurminenovy metody stratifikované podle stavu lymfatických uzlin, velikosti nádoru a volby dávkování karboplatiny.
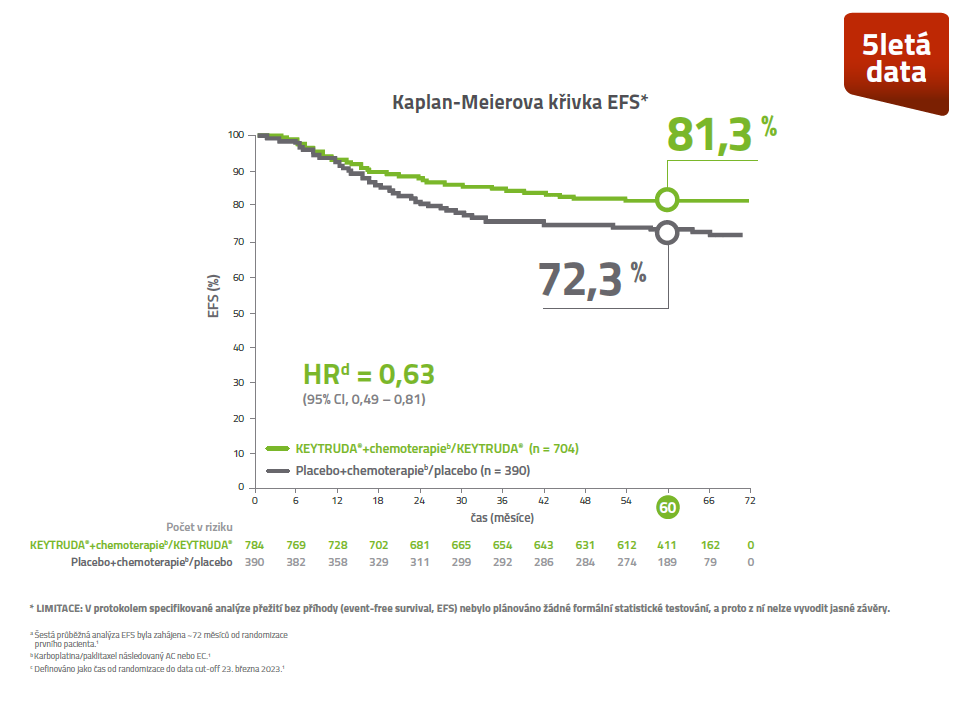
Kaplan-Meierova křivka EFS v ITT populaci3
U pacientek léčených v časném stádiu TNBC kombinací přípravku KEYTRUDA® + chemoterapie v neoadjuvanci a následně přípravkem KEYTRUDA® v monoterapii v adjuvanci došlo ke snížení rizika recidivy onemocnění o 37%.3
KEYNOTE-522: Při mediánu sledování 39,1 měsíce bylo prokázáno statisticky významné prodloužení EFSa při neoadjuvantním podání LP KEYTRUDA® plus chemoterapie následovaným adjuvantní léčbou LP KEYTRUDA® oproti neoadjuvantnímu podání placeba plus chemoterapie následovaným adjuvantním podáním placeba3
• EFS bylo definováno jako čas od randomizace do prvního výskytu kterékoliv z následujících příhod: progrese onemocnění znemožňující definitivní chirurgickou léčbu, lokální nebo vzdálená rekurence, vznik druhé primární malignity nebo smrt z jakékoliv příčiny.
• Odhadovaná míra přežití bez příhody po 36 měsících byla 84,5 % (95% CI: 81,7–86,8) ve skupině s neoadjuvantním podáváním LP KEYTRUDA® plus chemoterapie následovaným adjuvantní léčbou LP KEYTRUDA® v porovnání se 76,8 % (95% CI: 72,2–80,7) ve skupině s neoadjuvantním podáváním placeba plus chemoterapie, následovaným podáváním placeba.3
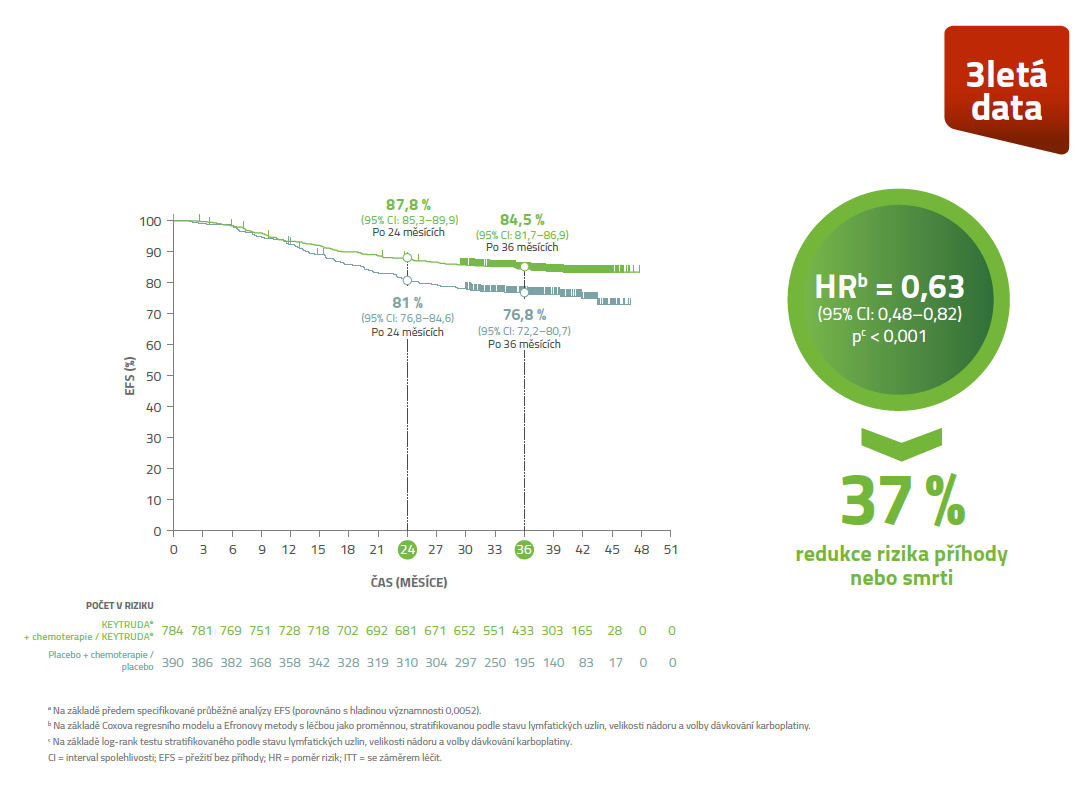
a Na základě předem specifikované průběžné analýzy EFS (porovnáno s hladinou významnosti 0,0052).
b Na základě Coxova regresního modelu a Efronovy metody s léčbou jako proměnnou, stratifikovanou podle stavu lymfatických uzlin, velikosti nádoru a volby dávkování karboplatiny.
c Na základě log-rank testu stratifikovaného podle stavu lymfatických uzlin, velikosti nádoru a volby dávkování karboplatiny.
Analýza přežití bez příhody v podskupinách3
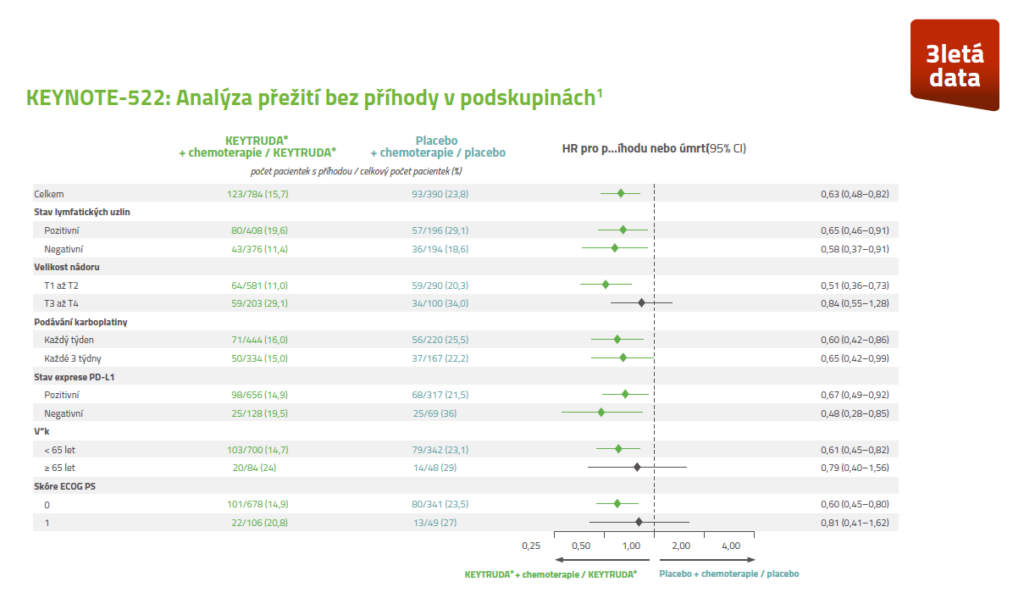
U pacientek léčených v časném stadiu TNBC kombinací přípravku KEYTRUDA® + chemoterapie v neoadjuvanci a následně přípravkem KEYTRUDA® v monoterapii v adjuvanci došlo ke klinicky významnému snížení rizika recidivy onemocnění i po 5 letech bez ohledu na expresi PD-L1.5,*
EFSa v protokolem předem specifikované, šesté průběžné analýze pro pacienty léčené kombinací KEYTRUDA® + chemoterapieb / KEYTRUDA® vs. placebo + chemoterapieb / placebo.5,*
Medián sledováníc: 63,1 měsíce (53,9-72,0)
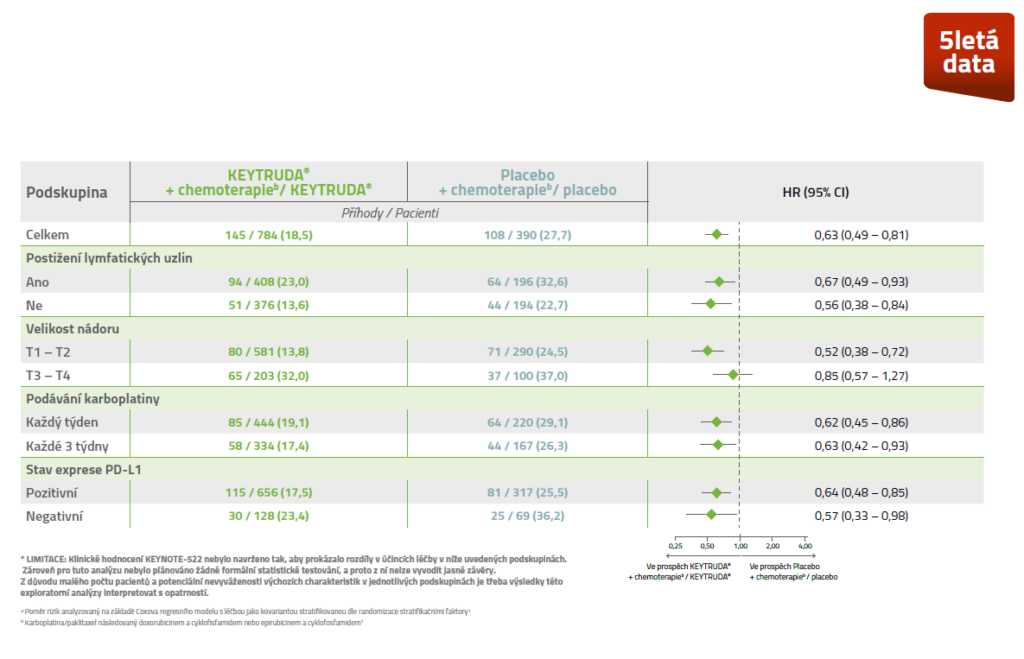
EFS napříč předem specifikovanými podskupinami5,*
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
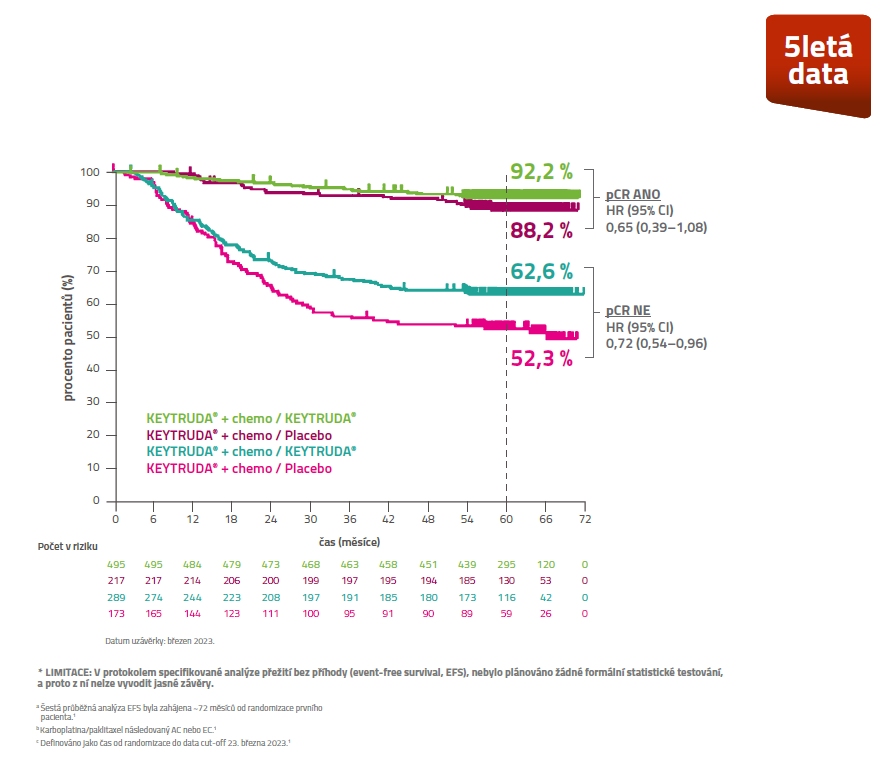
EFS dle PCR (ypT0/Tis ypNO)*
EFSa v protokolem předem specifikované, šesté průběžné analýze pro pacienty léčené kombinací KEYTRUDA® + chemoterapieb / KEYTRUDA® vs. placebo + chemoterapieb / placebo.5,*
Medián sledováníc: 63,1 měsíce (53,9-72,0)
Pacienti mají být léčeni přípravkem KEYTRUDA® v kombinaci s chemoterapií v neoadjuvantním podání. Poté pokračovat v adjuvantním podávání přípravku KEYTRUDA® v monoterapii po chirurgickém výkonu.1
Dávkování2,3

Reference
1. SPC přípravku KEYTRUDA® na www.sukl.cz. Datum poslední revize 12. 10. 2023.
2. Schmid P et al. Pembrolizumab for early triple-negative breast cancer. NEJM 2020;382:810-21.
3. Schmid P et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. NEJM 2022;386:556-67.
4. Supplement to: Schmid P et al. Event-free survival with pembrolizumab-in early triple-negative breast cancer. NEJM 2022;386:556-67.
5. Schmid P, Cortez J, Dent R, et al. Pembrolizumab or placebo + chemotherapy followed by pembrolizumab or placebo for early-stage triple-negative breast cancer: updated event-free survival results from the phase 3 KEYNOTE-522 study. Slide deck presented at: European Society for Medical Oncology; October 20, 2023; Madrid, Spain.
TNBC = triple-negativní karcinom prsu; PD-L1 = ligand receptoru programované buněčné smrti 1; AUC = plocha pod křivkou; ECOG PS = výkonnostní stav dle Eastern Cooperative Oncology Group; PD-1 = receptor programované buněčné smrti 1. HR = poměr rizik; R = randomizace; pCR = patologická kompletní odpověď; EFS = přežití bez příhody; HER2 = lidský epidermální růstový faktor 2; ULN = horní hranice normálu; AC = doxorubicin + cyklofosfamid; EC = epirubicin + cyklofosfamid; ITT = se záměrem léčit.
Zkušenosti s léčbou přípravkem KEYTRUDA® u pacientek s časným triple-negativním karcinomem prsu s vysokým rizikem recidivy
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Diagnostika pacientek s triple-negativním karcinomem prsu
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Léčba pacientů s pokročilým triple-negativním karcinomem prsu
Design klinické studie KEYNOTE-3551,2
Přípravek KEYTRUDA® byl zkoumán s třemi různými chemoterapeutickými režimy (paklitaxel, nab-paklitaxel nebo gemcitabin s karboplatinou) v multicentrickém, randomizovaném, dvojitě zaslepeném, placebem kontrolovaném klinickém hodnocení fáze 3 s 847 pacienty s pokročilým TNBC.1,2
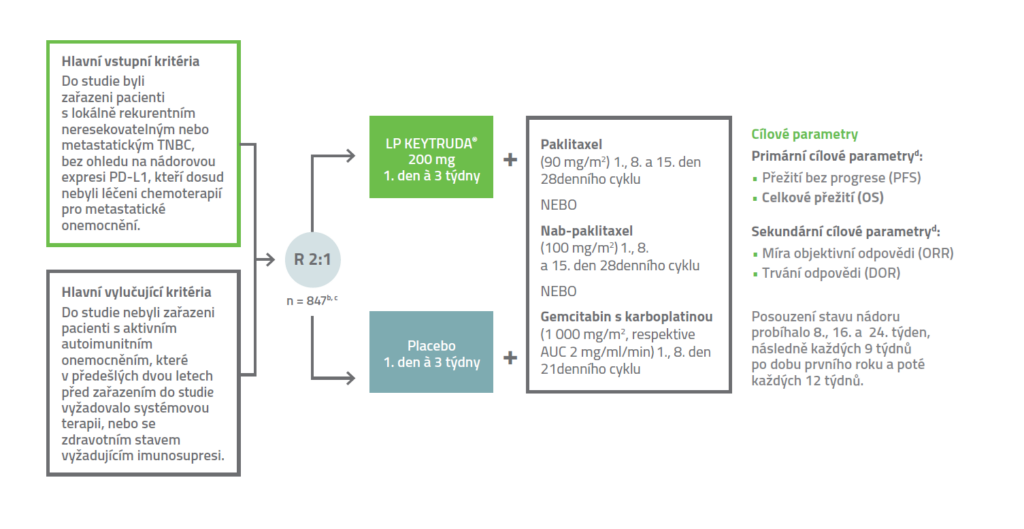
Léčba pembrolizumabem nebo placebem pokračovala do progrese onemocnění, nepřijatelné toxicity nebo do doby maximálně 24 měsiců.
b Randomizace (2 : 1) byla stratifikována podle chemoterapeutického režimu (paklitaxel nebo nab-paklitaxel nebo gemcitabin s karboplatinou), nádorové exprese PD-L1 (CPS ≥ 1 vs. CPS < 1) stanovené pomocí soupravy PD-L1 IHC 22C3 pharmDx a předchozí léčby stejnou třídou chemoterapie v neoadjuvantním podání (ano vs. ne).
c Všechna studijní medikace byla podávána intravenózní infuzí.
d Hodnoceno zaslepenou centrální nezávislou komisí (BICR). PFS hodnocené BICR na základě kritérií hodnocení odpovědi na léčbu u solidních nádorů (RECIST v1.1), modifikovaných ke sledování maximálně 10 cílových lézí a maximálně pěti cílových lézí na vyšetřovaný orgán v podskupině pacientů s CPS ≥ 10.
AUC = plocha pod křivkou; IHC = imunohistochemie.
Výchozí charakteristiky, ITT4
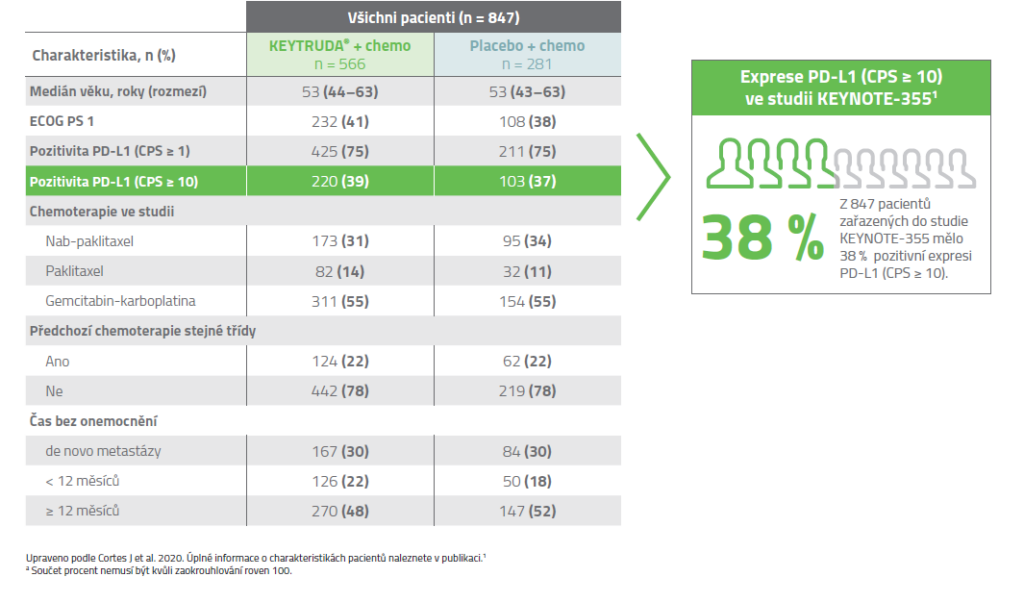
Výsledky klinické studie KEYNOTE-3551,2,5
38 % (323/847) pacientů s pokročilým TNBC v klinické studii KEYNOTE-355 mělo nádory exprimující PD-L1 s CPS ≥ 10.1,2
Studie prokázala 35% snížení rizika progrese nebo úmrtí (HR = 0,65; 95% CI 0,49–0,86; p = 0,0012a) u pacientů s nádory exprimujícími PD-L1 s CPS ≥ 10 randomizovaných do léčebného ramene pembrolizumabu v kombinaci s chemoterapií ve srovnání s placebem v kombinaci s chemoterapií.1,2,5
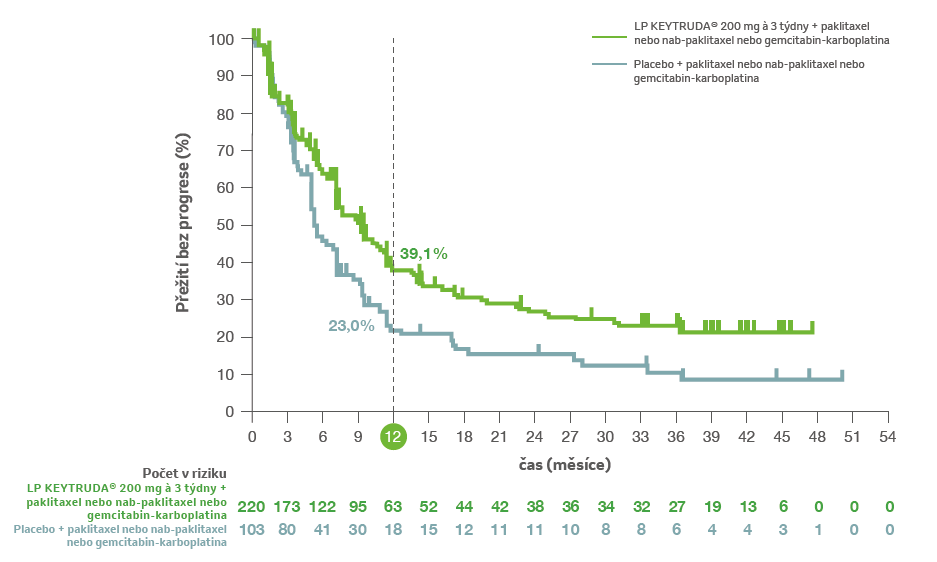
a HR na základě stratifikovaného Coxova regresního modelu. Jednostranná hodnota p na základě stratifikovaného log rank testu.
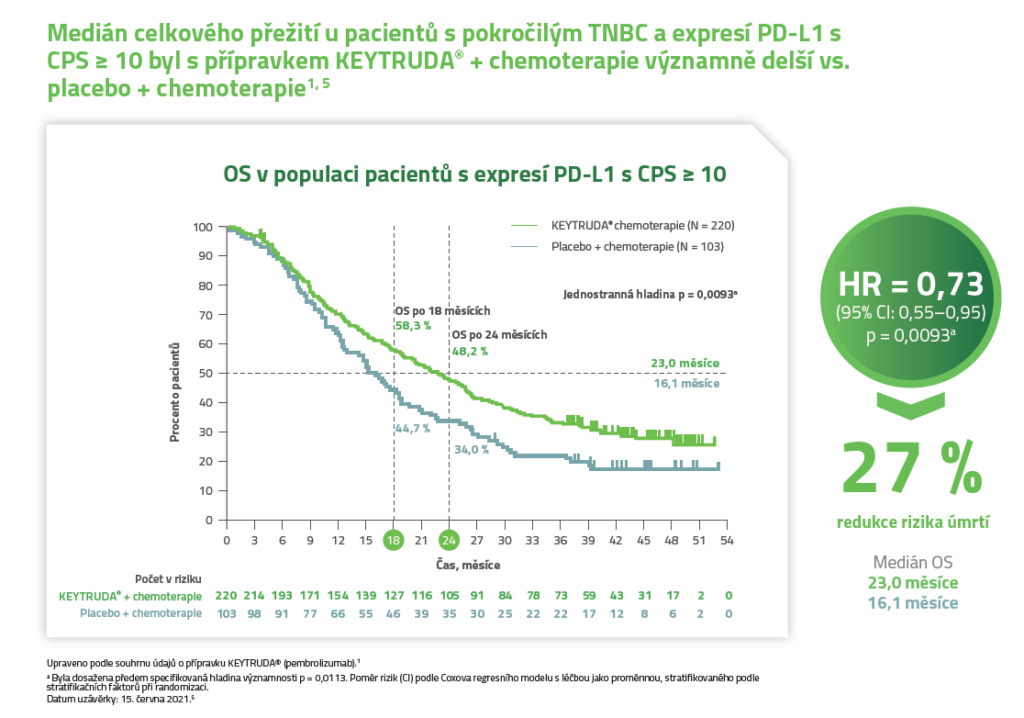
OS v populaci pacientů s expresí PD-L1 s CPS ≥ 101,5
PŘEŽITÍ BEZ PROGRESE (PFS)3
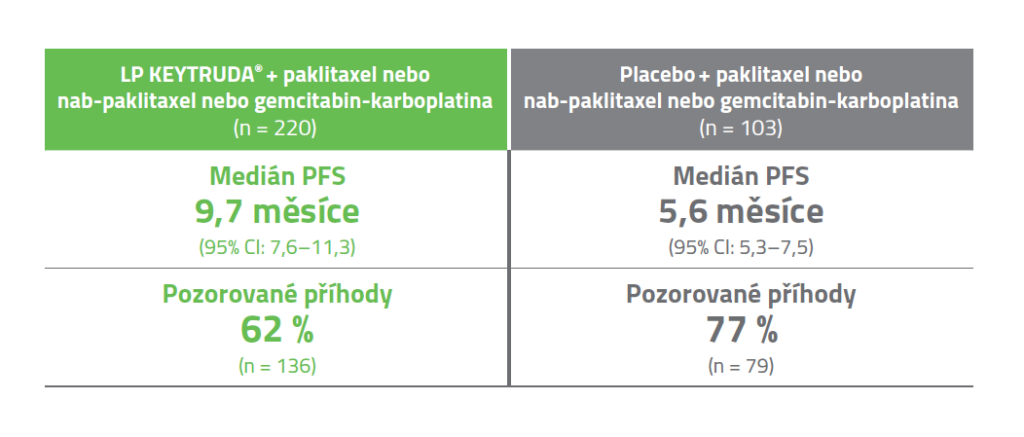
MÍRA OBJEKTIVNÍ ODPOVĚDI (ORR)3
Hodnoceno bylo u 220 pacientů s CPS ≥ 10 v rameni KEYTRUDA + paklitaxel nebo nab-paklitaxel nebo gemcitabin-karboplatina a u 103 pacientů s CPS ≥ 10 v rameni placebo + paklitaxel nebo nab-paklitaxel nebo gemcitabin-karboplatina.
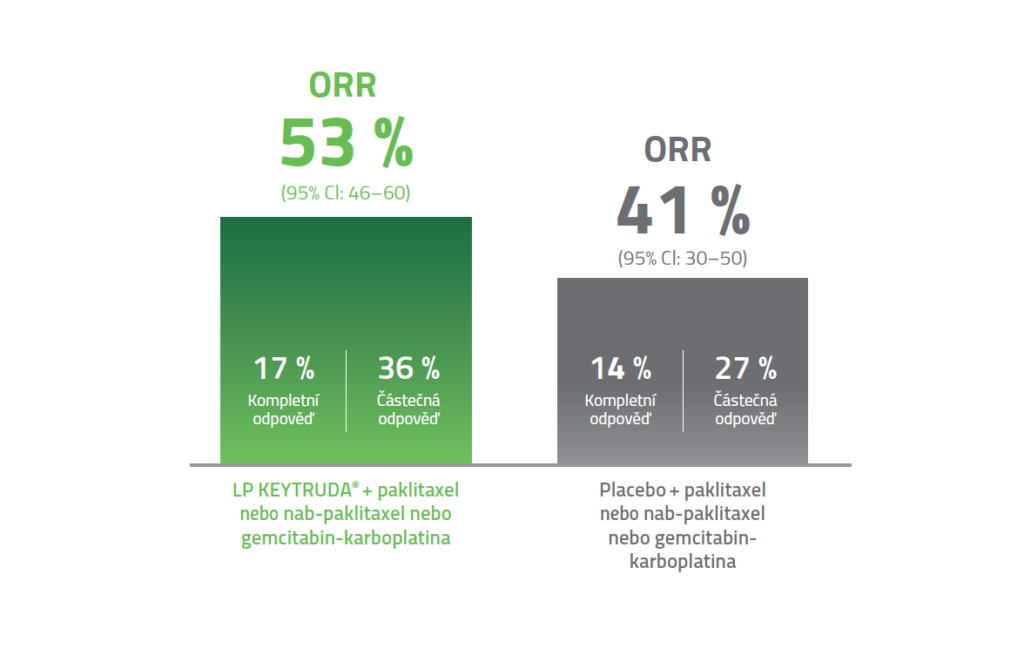
TRVÁNÍ ODPOVĚDI3

Reference
1. Cortes J et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265):1817-1828.
2. Cortes J et al. Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial. Lancet 2020; 396(10265):1817-1828. Supplementary appendix.
3. Cortes J et al. Pembrolizumab plus Chemotherapy in Advanced Triple-Negative Breast Cancer. N Engl J Med. 2022;387(3):217-226.
4. SPC přípravku KEYTRUDA® na www.sukl.cz, datum poslední revize textu 12. 10. 2023.
5. Rugo HS et al. KEYNOTE-355: Final results from a randomized, double-blind, phase 3 study of first-line pembrolizumab + chemotherapy versus placebo chemotherapy for metastatic triple-negative breast cancer. Presented at ESMO 2021.
CPS = kombinované pozitivní skóre; CI = interval spolehlivosti; HR = poměr rizik; nab-paklitaxel = paklitaxel ve vazbě na protein; PD-L1 = ligand receptoru programované buněčné smrti 1.
Bezpečnost
Bezpečnostní profil dle studie KEYNOTE-522
KEYNOTE-522: S léčbou související nežádoucí příhody (TRAE) v kombinovaných fázích léčby (neo/adjuvantní) při IA41,2
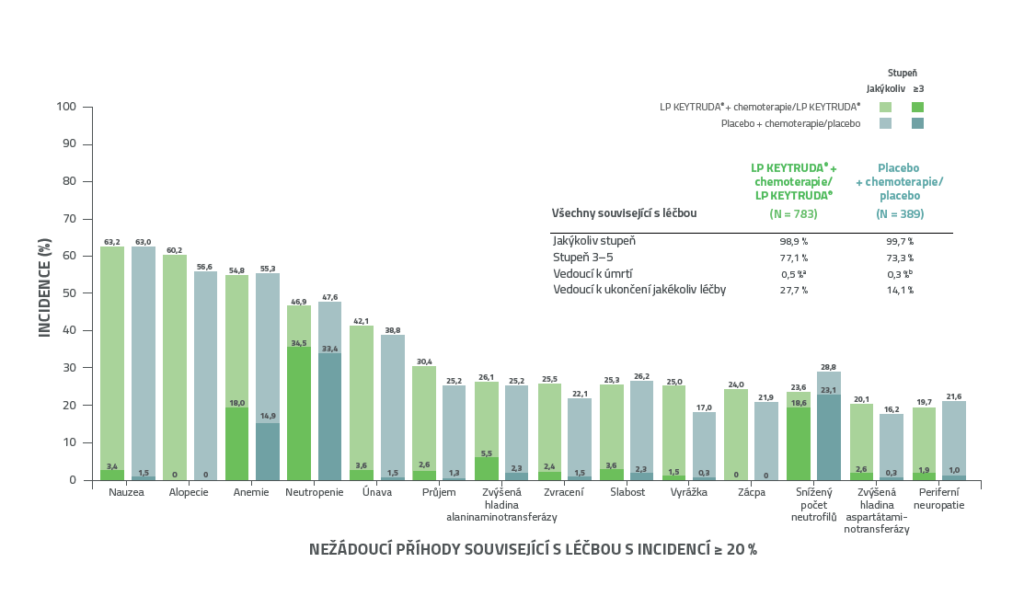
• Většina nežádoucích příhod souvisejících s léčbou byla zaznamenána během fáze neoadjuvantní léčby, v porovnání s adjuvantní fází.2
• Ve skupině s LP KEYTRUDA® nebyl zaznamenán žádný nový bezpečnostní signál.2
a 1 pacientka zemřela na sepsi a syndrom multiorgánového selhání, 1 pacientka na pneumonitidu, 1 pacientka na plicní embolii a 1 pacientka na autoimunitní encefalitidu.
b 1 pacientka zemřela na septický šok.
AEs = Adverse events
Datum uzamčení databáze: 23. března 2021
KEYNOTE- 522: Imunitně podmíněné (imAE) nežádoucí příhody a reakce na infuzi v kombinovaných fázích léčby (neo/adjuvantní) při IA41,2
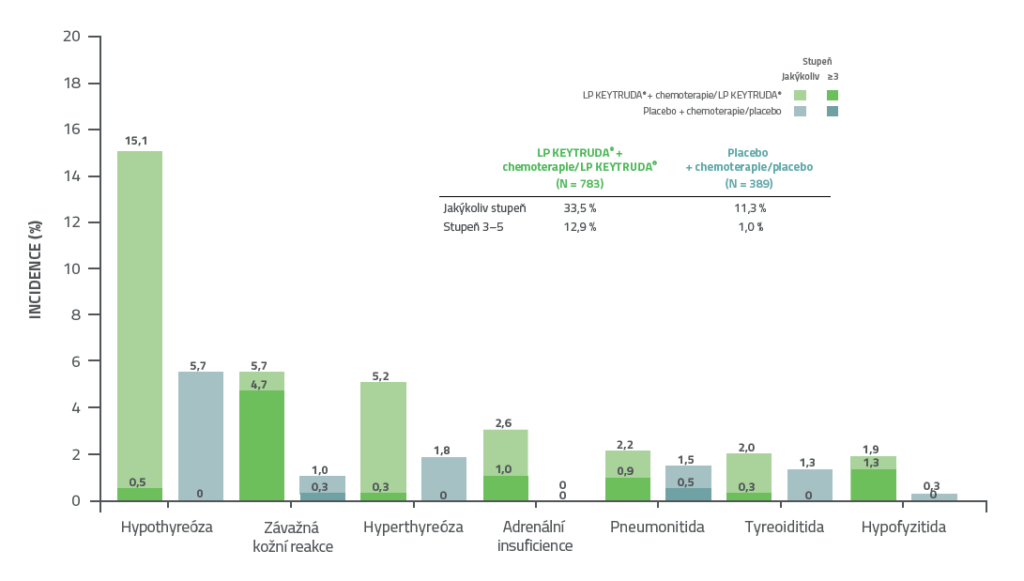
• Většina nežádoucích příhod souvisejících s léčbou byla zaznamenána během fáze neoadjuvantní léčby, v porovnání s adjuvantní fází.2
• Ve skupině s přípravkem KEYTRUDA®nebyl zaznamenán žádný nový bezpečnostní signál.2
Datum uzamčení databáze: 23. března 2021
KEYNOTE-522: Imunitně podmíněné nežádoucí příhody a reakce na infuzi v adjuvantní fázi léčby při IA41,2
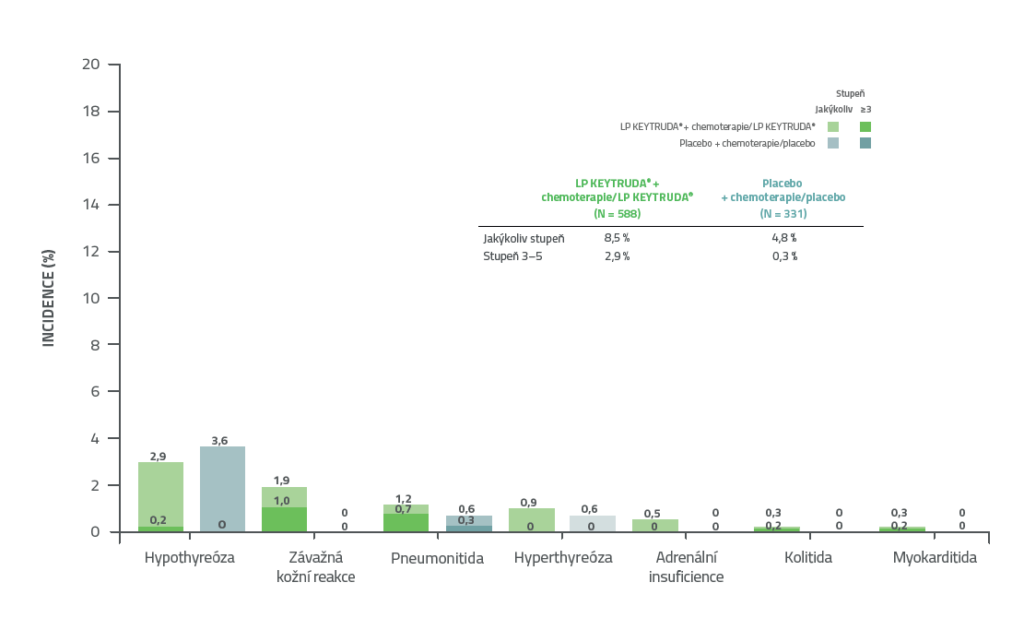
• Většina nežádoucích příhod souvisejících s léčbou byla zaznamenána během fáze neoadjuvantní léčby, v porovnání s adjuvantní fází.2
• Ve skupině s přípravkem KEYTRUDA® nebyl zaznamenán žádný nový bezpečnostní signál.2
Datum uzamčení databáze: 23. března 2021
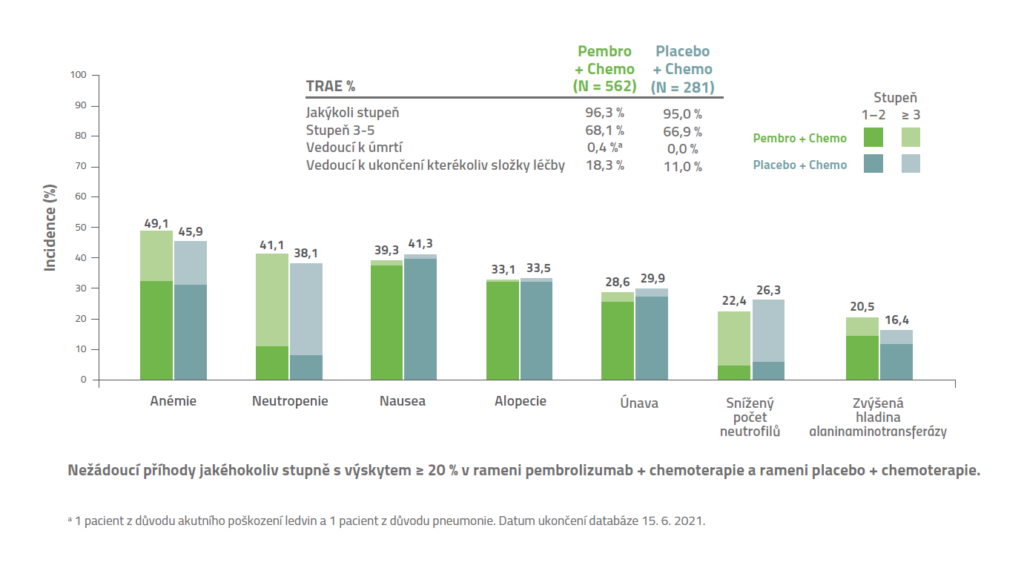
Bezpečnostní profil dle studie KEYNOTE-355
KEYNOTE-355: S léčbou související nežádoucí příhody (TRAE)3
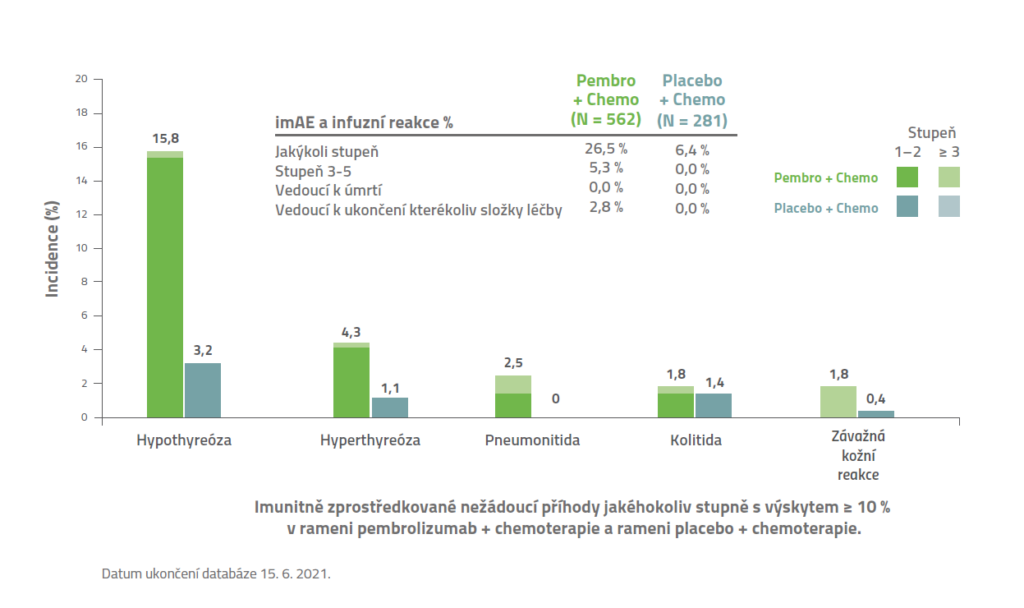
KEYNOTE-355: Imunitně podmíněné nežádoucí příhody a reakce na infuzi3
Reference
1. Schmid P et al. Pembrolizumab for early triple-negative breast cancer. NEJM 2020;382:810-21.
2. Schmid P et al. Event-free survival with pembrolizumab in early triple-negative breast cancer. NEJM 2022;386:556-67.
3. Cortes J, Cescon D, Rugo H & all. KEYNOTE-355 Pembrolizumab plus chemotherapy versus placebo plus chemotherapy for previously untreated locally recurrent inoperable or metastatic triple-negative breast cancer (KEYNOTE-355): a randomised, placebo-controlled, double-blind, phase 3 clinical trial Lancet 2020; 396; 1817-28.
Podmínky úhrady
Lokálně pokročilý nebo časný triple-negativní karcinom prsu s vysokým rizikem recidivy1,2
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.
Pembrolizumab je hrazen u dospělých pacientů v kombinaci s chemoterapií v neoadjuvantní léčbě a následně po chirurgické léčbě v adjuvantní léčbě v monoterapii u pacientů s časným triple-negativním karcinomem prsu s vysokým rizikem recidivy.
Léčba je hrazena u pacientů se stavem výkonnosti 0-1 dle ECOG.V případě nutnosti ukončení léčby jedné složky z podávané kombinace z důvodu její netolerance je možné pokračovat v podávání ostatních léčiv. Léčba je hrazena maximálně po dobu 12 měsíců od zahájení neoadjuvantní fáze léčby.

Lokálně rekurentní neresekovatelný nebo metastazující triple-negativní karcinomu prsu1,3
Pembrolizumab je v kombinaci s paklitaxelem hrazen k léčbě lokálně rekurentního neresekovatelného nebo metastazujícího triple-negativního karcinomu prsu u dospělých, jejichž nádory exprimují PD-L1 s CPS ≥ 10.
Pacienti kumulativně splňují následující podmínky:
a) výkonnostní stav 0-1 dle ECOG;
b) bez předchozí systémové léčby pro metastatické onemocnění;
c) bez přítomnosti klinicky aktivních mozkových metastáz anebo jsou mozkové metastázy adekvátně léčené;
d) nejsou indikováni k chemoterapeutickému režimu na bázi platiny ani k režimu na bázi antracyklinu.
Kombinace pembrolizumabu s paklitaxelem vázaným na albumin je za předpokladu splnění výše uvedených podmínek hrazena pouze u pacientů nevhodných k léčbě paklitaxelem z důvodu kontraindikace nebo nežádoucích účinků.

Reference
1. SPC přípravku KEYTRUDA® na www.sukl.cz.
2. Podmínky úhrady přípravku KEYTRUDA® v indikaci časného triple-negativního karcinomu prsu s vysokým rizikem recidivy na www.sukl.cz.
3. Podmínky úhrady přípravku KEYTRUDA® v indikaci metastatického triple-negativního karcinomu prsu na www.sukl.cz.
CZ-OBR-00008 (8.0), datum přípravy: duben 2024
Zkrácená informace o přípravku KEYTRUDA® k dispozici ZDE.














