Indikace
cHL
Klasický Hodgkinův lymfom
Terapeutická indikace
LP KEYTRUDA® je v monoterapii indikován k léčbě dospělých a pediatrických pacientů ve věku od 3 let s relabujícím nebo refrakterním klasickým Hodgkinovým lymfomem, u nichž selhala autologní transplantace kmenových buněk (autologous stem cell transplant – ASCT), nebo byli léčeni alespoň dvěma předchozími terapiemi, přičemž ASCT není možností léčby1.
1. SPC LP Keytruda na www.sukl.cz
Podmínky úhrady
Pembolizumab je hrazen:1
V monoterapii u pacientů s relabujícím nebo refrakterním klasickým Hodgkinovým lymfomem, kteří byli léčeni alespoň dvěma předchozími liniemi léčby a autologní transplantace pro ně nepředstavuje léčebnou možnost. Jedná se o pacienty ve velmi dobrém stavu výkonnosti (ECOG 0-1). Pembrolizumab je hrazen do progrese onemocnění či nepřijatelné toxicity léčby, dle toho, co nastane dříve, maximálně do vyčerpání 35 cyklů léčby.
1. Rozhodnutí o uhradě přípravku KEYTRUDA®, Sp.zn.: SUKLS269531/2023
Design klinické studie KEYNOTE-204
Základní přehled
Randomizovaná, otevřená, kontrolovaná klinická studie fáze 3 porovnávající přípravek LP KEYTRUDA® s Brentuximab Vedotinem.1

Hlavní vylučující kritéria: Aktivní neinfekční pneumonidita vyžadující kortikosteroidy, aktivní autonomní onemocnění, zdravotní stav vyžadující imunopresi, alogenní HSCT v posledních pěti letech.
Randomizacee (1 : 1) (N = 304)
Studijní ramena
| LP KEYTRUDA® Léčba Přípravek LP KEYTRUDA® v dávce 200 mg intravenózně každé 3 týdny (n = 151) Trvání léčby Do nepřijatelné toxicity nebo potvrzení progrese onemocnění nebo maximálně 35 cyklů (až přibližně 2 roky). Hodnocení onemocnění prováděno každých 12 týdnů. |
| BRENTUXIMAB VEDOTIN Léčba Brentuximab vedotin v dávce 1,8 mg/kg intravenózně každé 3 týdny (n = 153) Trvání léčby Do nepřijatelné toxicity nebo potvrzení progrese onemocnění nebo maximálně 35 cyklů (až přibližně 2 roky). Hodnocení onemocnění prováděno každých 12 týdnů. |
Cílové parametry
Primární cíl klinické studie: PFS hodnocené zaslepenou nezávislou centrální komisí (BICR) pomocí revidovaných kritérií Mezinárodní pracovní skupiny (IWG) z roku 2007.
Charakteristiky pacientů
- Medián věku: 35 let (rozmezí: 18–84)
- Muži: 57 %
- Běloši: 77 %
- Asiaté: 9 %
- Afroameričané: 3,9 %
Předchozí léčba
- 18 % podstoupilo alespoň jednu předchozí linii léčby
- Medián počtu předchozích terapií s přípravkem LP KEYTRUDA®: 2 (rozmezí 1–10)
- Medián počtu předchozích terapií s BV: 3 (rozmezí: 1–11)
- 42 % refrakterní k poslední předchozí terapii
- 29 % primárně refrakterní onemocnění
- 37 % podstoupilo autologní HSCT
- 5 % dříve dostalo BV
- 39 % podstoupilo radioterapii
e. Randomizace byla stratifikována podle předchozí autologní HSCT (ano vs. ne) a stavu onemocnění po terapii v první linii (primárně refrakterní vs. relaps během <12 měsíců po skončení vs. relaps během ≥12 měsíců po skončení).
HSCT = transplantace hematopoetických kmenových buněk.
Reference
1.Kuruvilla J, Ramchandren R, Santoro A, et al. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021;22(4):512-524.
2. Chen R, Zinzani PL, Fanale MA, et al. Phase II study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. J Clin Oncol. 2017;35(19):2125-2132
Výsledky klinické studie KEYNOTE-204
Přežití bez progrese PFS
Kaplan-Meierovy odhady PFS s přípravkem LP KEYTRUDA® v porovnání s Brentuximab Vedotinem (BV) v klinické studii KEYNOTE-204a,b
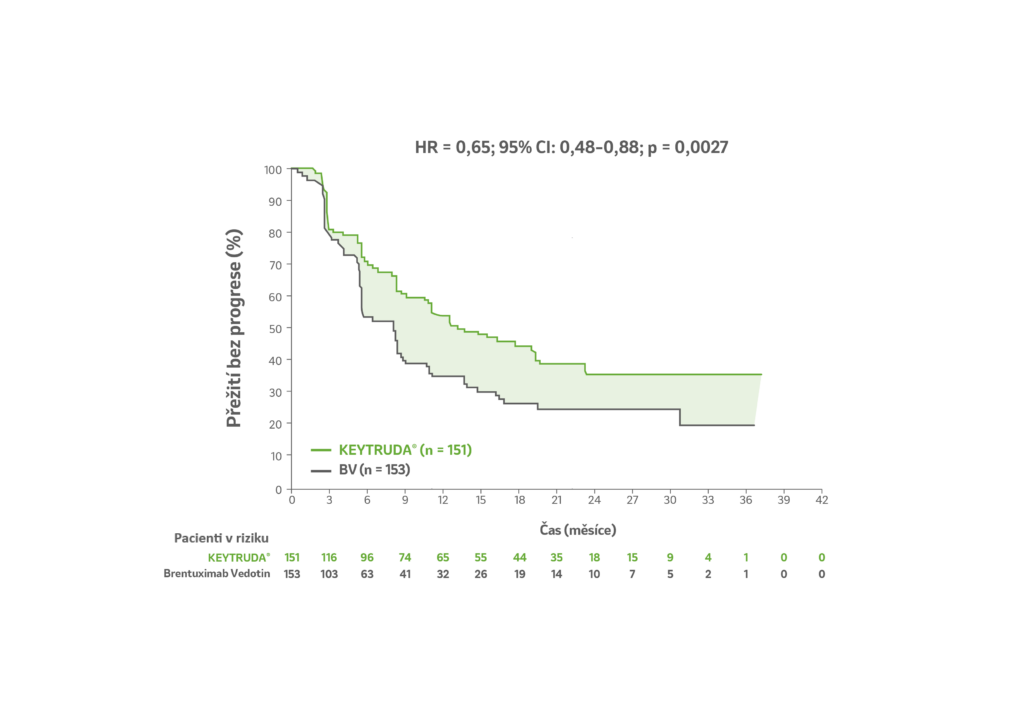
a. HR na základě stratifikovaného Coxova modelu proporcionálních rizik.
b. Hodnota p na základě stratifikovaného log-rank testu. Jednostranná hodnota p s předem specifikovanou hranicí 0,0043.

| LP KEYTRUDA® (n=151) | Brentuximab Vedotin (n=153) |
| Počet pacientů s příhodou 54% (n = 81/151 ) | Počet pacientů s příhodou 58% (n = 88/153 ) |
| Medián PFSc 13,2 měsíce (95% CI: 10,9 – 19, | Medián PFSC 8,3 měsíce (95% CI: 5,7 – 8,8) |
HR = poměr rizik; CI = interval spolehlivosti
Míra objektivní odpovědi (ORR)
u 151 pacientů léčených přípravkem LP KEYTRUDA®

Míra objektivní odpovědi (ORR)
u 153 pacientů léčených Brentuximabem Vedotinem

Doplňující informace
Rozdíl v parametru ORR není statisticky významný.
Trvání odpovědi (DOR)
| LP KEYTRUDA® | Brentuximab Vedotin |
| Medián DORd 20,7 měsíce (rozmezí: 0,0+ až 33,2+ měsíce) | Medián DORd 13,8 měsíce (rozmezí: 0,0+ až 33,9+ měsíce) |
Označuje cenzurovanou hodnotu.

Reference
1. Kuruvilla J, Ramchandren R, Santoro A, et al. Pembrolizumab versus brentuximab vedotin in relapsed or refractory classical Hodgkin lymphoma (KEYNOTE-204): an interim analysis of a multicentre, randomised, open-label, phase 3 study. Lancet Oncol. 2021;22(4):512-524.
2.Chen R, Zinzani PL, Fanale MA, et al. Phase II study of the efficacy and safety of pembrolizumab for relapsed/refractory classic Hodgkin lymphoma. J Clin Oncol. 2017;35(19):2125-2132
Flexibilní dávkování
Jednou za 3 týdny nebo 6 týdnů napříč všemi indikacemi v monoterapii1

Doporučený Q3W dávkovací režim u pediatrických pacientů: ve věku od 3 let s cHL nebo pacientů od 12 let s melanomem je 2 mg/kg tělesné hmotnosti (bw – bodyweight) (až do maximální dávky 200 mg) každé 3 týdny, dávka se podává intravenózní infuzí po dobu 30 minut.1
Reference
1. SPC přípravku KEYTRUDA® na www.sukl.cz
2.Lala M, Li TR, de Alwis DP, Sinha V, Mayawala K, Yamamoto N, Siu LL, Chartash E, Aboshady H, Jain L. A six-weekly dosing schedule for
pembrolizumab in patients with cancer based on evaluation using modelling and simulation. Eur J Cancer. 2020 May;131:68-75. doi: 10.1016/j.ejca.2020.02.016. Epub 2020 Apr 15. Erratum in: Eur J Cancer. 2021 Feb;144:400. PMID: 32305010.
CZ-PDO-00122 (1.0), říjen 2024









