Indikace
MSI-H/dMMR CRC
Terapeutické indikace1
MSI-H/dMMR kolorektální karcinom (MSI-H/dMMR CRC)
Přípravek KEYTRUDA® je v monoterapii indikován pro dospělé s MSI-H nebo dMMR kolorektálním karcinomem v následujících režimech:
• v první linii k léčbě metastazujícího kolorektálního karcinomu;
• k léčbě neresekovatelného nebo metastazujícího kolorektálního karcinomu po předchozí kombinované léčbě založené na fluorpyrimidinu.
Výsledky klinické studie KEYNOTE-177
Design klinické studie KEYNOTE-1771,3
Multicentrické, randomizované, otevřené, aktivním komparátorem kontrolované klinické hodnocení fáze 3.
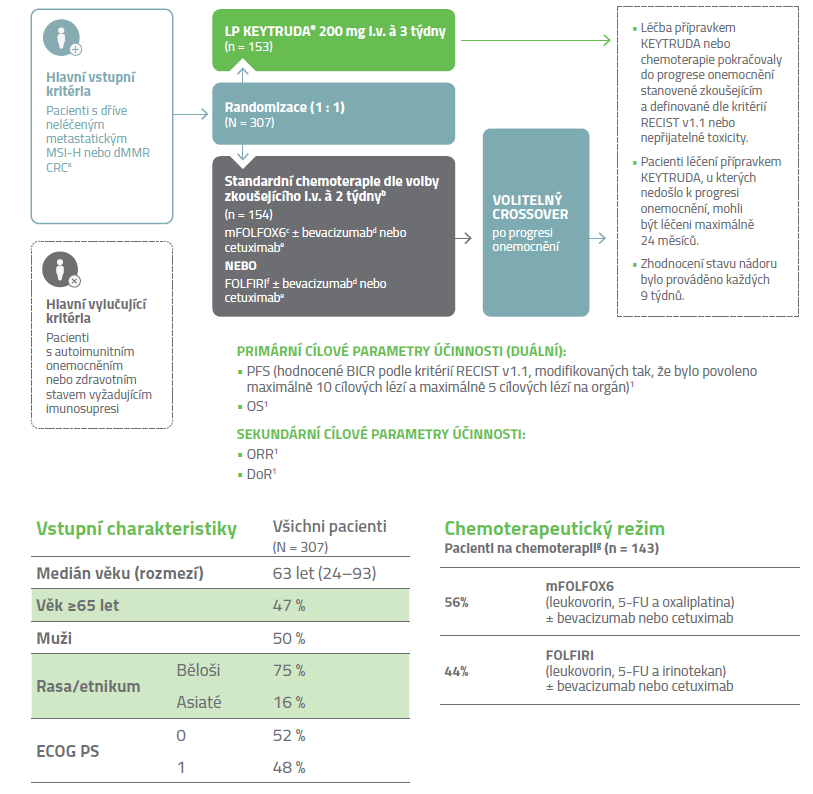
Upraveno podle souhrnu údajů o přípravku KEYTRUDA.1
a MSI nebo MMR nádorový status byl určen lokálně za pomoci polymerázové řetězové reakce (PCR), nebo imunohistochemicky (IHC).
b Pacientům randomizovaným k chemoterapii byla po progresi onemocnění
nabídnuta léčba přípravkem KEYTRUDA.
c Oxaliplatina 85 mg/m2, leukovorin 400 mg/m2 (nebo levoleukovorin 200 mg/m2) a 5-FU 400 mg/m2 bolus 1. den, následně 5-FU 2400 mg/m2 během 46–48 hodin.
d Bevacizumab 5 mg/kg 1. den. e Cetuximab 400 mg/m2 při první infuzi, následně každý týden 250 mg/m2. f Irinotekan 180 mg/m2, leukovorin 400 mg/m2 (nebo levoleukovorin 200 mg/m2) a 5-FU 400 mg/m2
bolus 1. den, následně 5-FU 2400 mg/m2 během 46–48 hodin. g Ze 154 pacientů randomizovaných do ramene se standardní chemoterapií jich podstoupilo chemoterapii 143.
Kaplan-Meierovy odhady PFS (duální primární cíl s OS) v populaci se záměrem léčit (ITT) po mediánu sledování 27,6 měsíce (rozmezí: 0,2-48,3 měsíce)3
40% redukce rizika progrese onemocnění nebo úmrtí s LP KEYTRUDA® vs. standardní chemoterapie (± bevacizumab, cetuximab)*1, 3
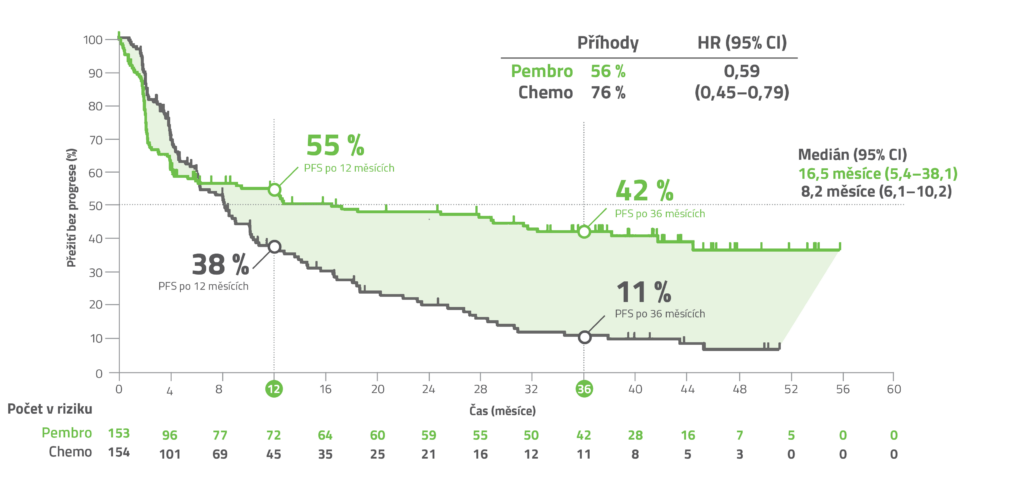
Upraveno podle souhrnu údajů o přípravku KEYTRUDA1 a André T et al. 2020.3
PFS bylo hodnocené BICR podle kritérií RECIST v1.1, modifikovaných tak, že bylo povoleno maximálně 10 cílových lézí a maximálně 5 cílových lézí na orgán.
a Na základě Coxova regresního modelu.
b Dvoustranné, na základě log rank testu (hranice významnosti 0,0234). Jednostranná hodnota p je 0,0002.
c Dle volby zkoušejícího buď mFOLFOX6 (leukovorin, 5-FU a oxaliplatina) ± bevacizumab
nebo cetuximab nebo FOLFIRI (leukovorin, 5-FU a irinotekan) ± bevacizumab nebo cetuximab.
* HRa: 0,60 (95% CI: 0,45–0,80; pb = 0,0004)
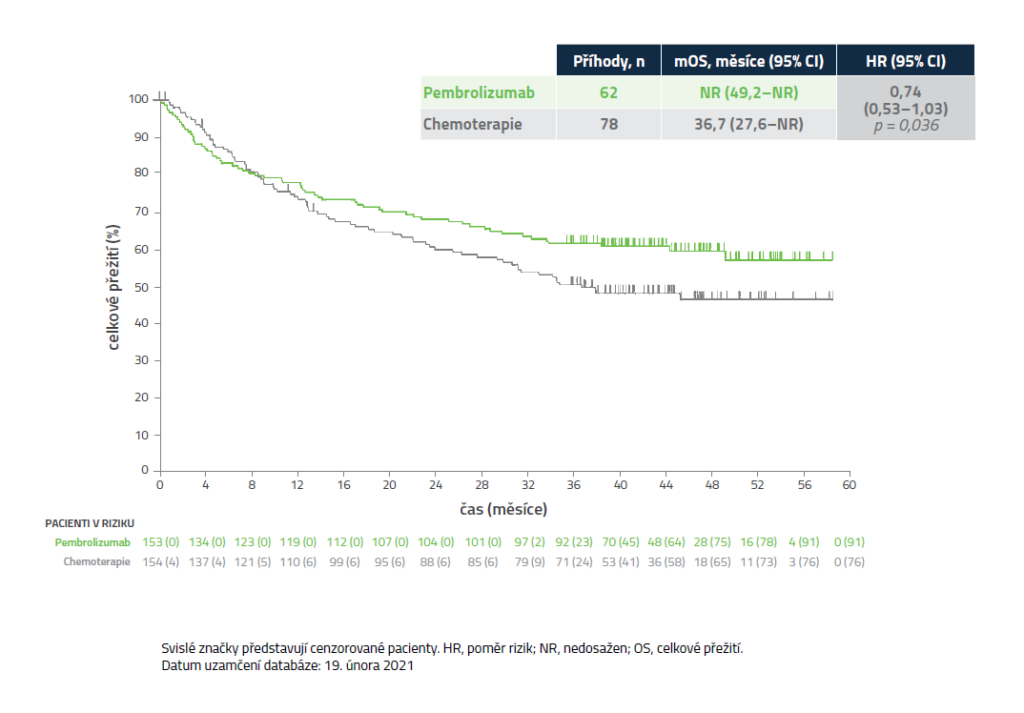
Celkové přežití (OS)5
Ve finální analýze nedosáhl výsledek OS s pembrolizumabem vs. chemoterapie hranice jednostranné hladiny α = 0,025 pro superioritu.
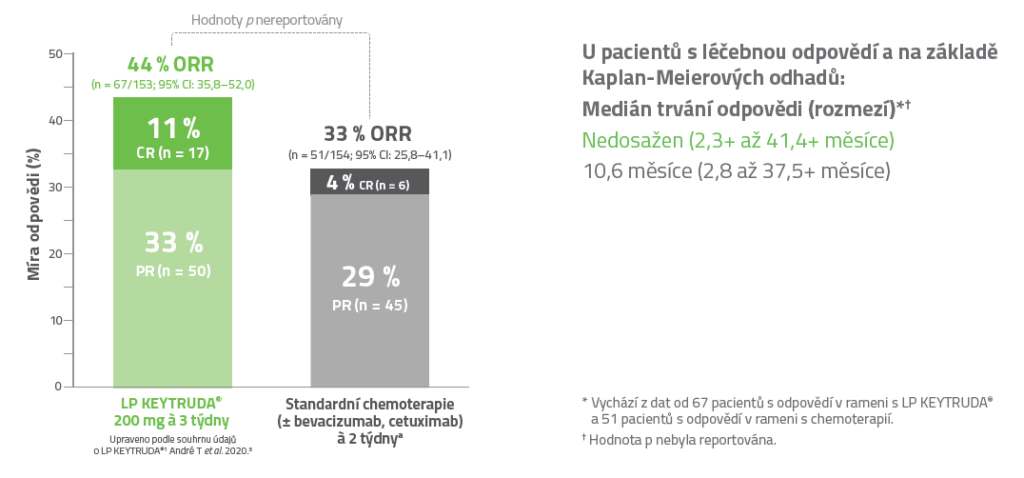
Sekundární cílové parametry účinnosti v populaci se záměrem léčit (ITT) po mediánu sledování 27,6 měsíce (rozmezí: 0,2-48,3 měsíce)3
Bezpečnost
Vybrané nežádoucí účinky
Závažné a fatální imunitně zprostředkované nežádoucí účinky1
Přípravek KEYTRUDA je humánní monoklonální protilátka, která se váže na receptor programované buněčné smrti PD‑1 (programmed cell death‑1) a blokuje jeho interakci s ligandy PD‑L1 a PD‑L2. Receptor PD‑1 je negativním regulátorem aktivity T‑buněk, u kterého bylo prokázáno, že se podílí na regulaci T‑buněčné imunitní odpovědi. Zrušení inhibice imunitní odpovědi může potenciálně indukovat imunitně zprostředkované nežádoucí účinky. Imunitně zprostředkované nežádoucí účinky, které mohou být závažné nebo fatální, mohou postihnout kterýkoliv orgánový systém nebo tkáň, mohou se vyskytnout ve více orgánových systémech současně a mohou se objevit kdykoliv po zahájení léčby nebo po jejím ukončení. Důležité imunitně zprostředkované nežádoucí účinky, které jsou zde vyjmenovány, nemusí zahrnovat veškeré možné závažné a fatální imunitně zprostředkované nežádoucí účinky.
Při podezření na imunitně zprostředkované nežádoucí účinky má být zajištěno odpovídající vyšetření, aby se etiologie potvrdila, nebo aby se vyloučily jiné příčiny. Na základě závažnosti nežádoucího účinku má být pembrolizumab vysazen a podávány kortikosteroidy. Po zlepšení na stupeň ≤ 1 má být zahájeno postupné vysazování kortikosteroidů a ve vysazování se má pokračovat nejméně 1 měsíc. U pacientů, jejichž imunitně zprostředkované nežádoucí účinky nemohou být kontrolovány použitím kortikosteroidů, může být zváženo podávání jiných systémových imunosupresiv. Podrobné informace týkající se imunitně zprostředkovaných nežádoucích účinků najdete v aktuálním SPC přípravku Keytruda (bod 4.4)
Incidence vybraných imunitně zprostředkovaných nežádoucích účinků1
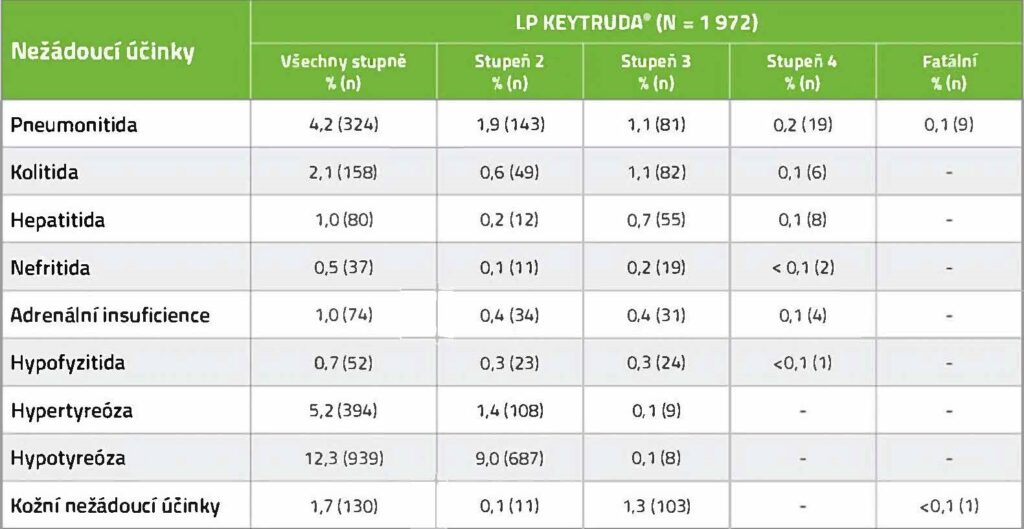
Bezpečnostní profil dle studie KEYNOTE-1773
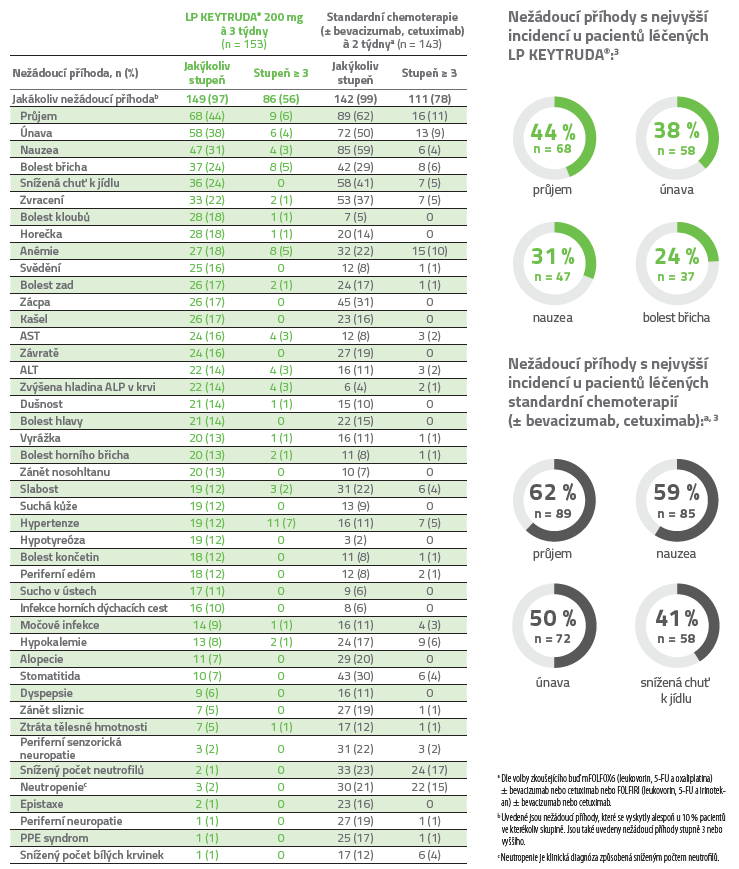
Nežádoucí příhody s výskytem u ≥ 10 % pacientů ve kterékoliv skupině v léčené populaci (všichni pacienti byli randomizováni a dostali alespoň jednu dávku studijní léčby)3
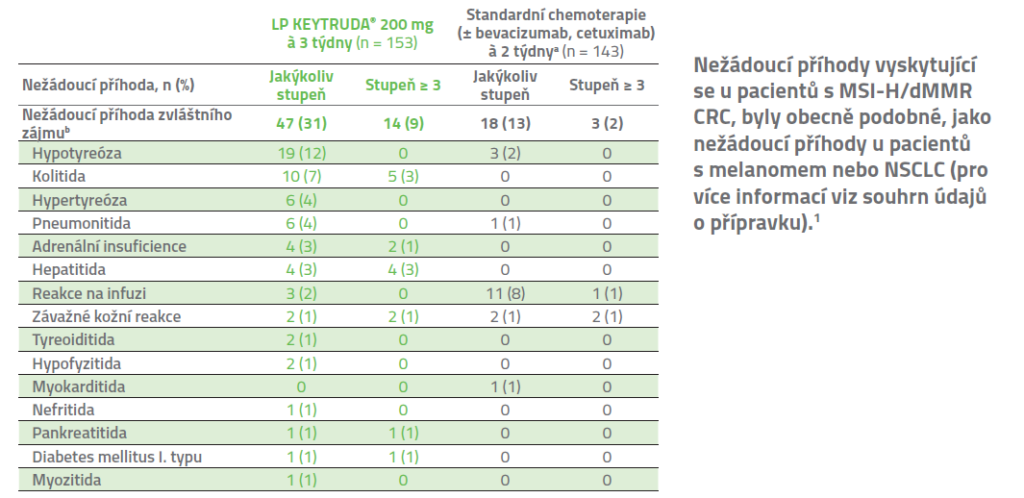
Nežádoucí příhody zvláštního zájmu, včetně imunitně zprostředkovaných nežádoucích příhod a infúzních reakcí3
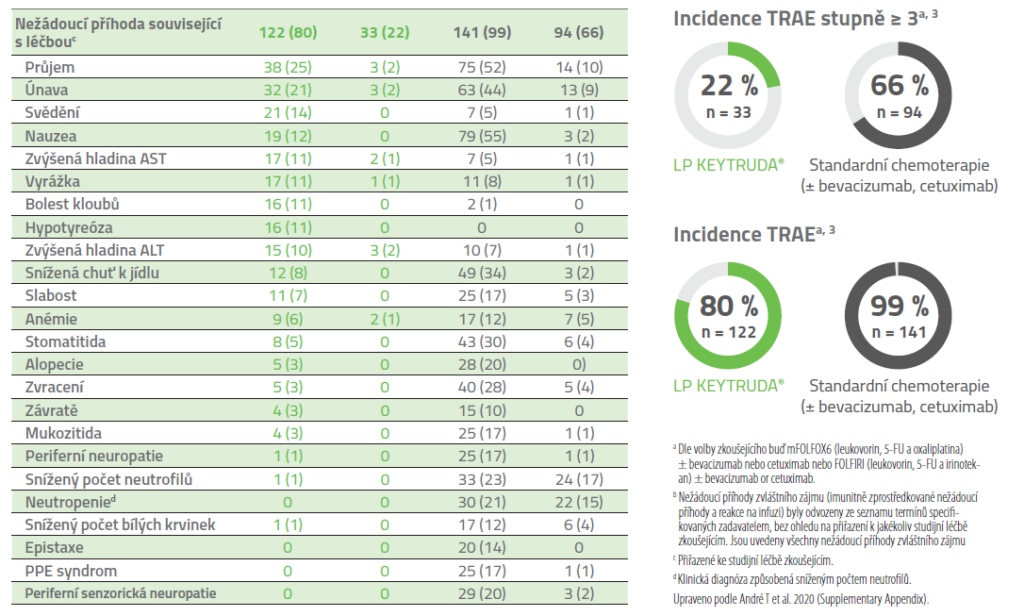
Nežádoucí příhody související s léčbou (TRAE) s výskytem u ≥ 10 % pacientů ve kterékoliv skupině v léčené populaci (všichni pacienti, kteří byli randomizováni a dostali alespoň jednu dávku studijní léčby)4
Reference
1. SPC přípravku KEYTRUDA® na www.sukl.cz, datum poslední revise 12. 10. 2023.
2. Andre T, Shiu K-K, Kim TW, et al. J Clin Oncol. 2021;39:(suppl 15; abstr 3500).
3. André T et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383(23): 2207–18.
4. André T et al. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med 2020; 383(23): 2207–18 (Supplementary Appendix).
5. Diaz et al. Lancet Oncol. 2022;23(5):659-670.
Zkratky:
5-FU: 5-fluorouracil. ALT: alaninaminotransferáza. AST: aspartátaminotransferáza. BICR: zaslepené nezávislé centrální hodnocení. CI: interval spolehlivosti. CR: kompletní odpověď. CRC: kolorektální karcinom. dMMR: deficit systému opravy chybného párování bazí. DoR: trvání odpovědi. ECOG PS: výkonnostní stav dle Eastern Cooperative Oncology Group. FOLFIRI: leukovorin, 5-FU, irinotekan. HR: poměr rizik. mFOLFOX6: leukovorin, 5-FU, oxaliplatina (modifikovaný režim). MMR: systém opravy chybného párování bazí. MSI: mikrosatelitová nestabilita. MSI-H: vysoká mikrosatelitová nestabilita. NSCLC: nemalobuněčný karcinom plic. ORR: míra objektivní odpovědi. OS: celkové přežití. PFS: přežití bez progrese. PPE: palmoplantární erytrodysestézie. PR: částečná odpověď. RECIST: Kritéria hodnocení odpovědi na léčbu u solidních nádorů. TRAE: nežádoucí příhoda související s léčbou.
Podmínky úhrady1
Pembrolizumab v monoterapii je hrazen u dospělých pacientů ve velmi dobrém stavu výkonnosti (ECOG 0-1) v první linii léčby metastazujícího kolorektálního karcinomu s vysokou mikrosatelitovou nestabilitou (microsatellite instability-high, MSI-H) nebo s deficitem systému opravy chybného párování bází (mismatch repair deficient, dMMR) za kumulativního splnění následujících podmínek:
a) pacient má výkonnostní stav 0–1 dle ECOG;
b) pacient nevykazuje přítomnost klinicky aktivních mozkových metastáz anebo mozkové metastázy jsou adekvátně léčené;
c) pacient není dlouhodobě léčen systémovými kortikosteroidy v dávce prednisonu nad 10 mg denně (či
odpovídajícím ekvivalentem) nebo jinou imunosupresivní lécbou;
d) pacient nemá diagnostikované závažné aktivní systémové autoimunitní onemocnění s výjimkou následujících onemocnění: diabetes mellitus I. typu, autoimunitní zánět štítné žlázy, kožní autoimunitní onemocnění (např. psoriáza, atopický ekzém, ložisková alopecie, vitiligo);
e) pacient má přijatelnou funkci ledvin a jater (hladina kreatininu je ≤ 1,5×ULN, hladina bilirubinu ≤ 1,5×ULN, u pacientů s Gilbertovým syndromem ≤ 3×ULN, hladina AST a ALT ≤ 3×ULN, v případě přítomnosti jaterních metastáz ≤ 5×ULN), a současně uspokojivé hodnoty krevního obrazu (hladina hemoglobinu ≥ 90 g/l, počet leukocytů ≥ 2,5×109/l, popřípadě počet leukocytů ≥ 2,0×109/l (při použití v léčbě NSCLC), počet neutrofilů ≥ 1,5×109/l, počet trombocytů ≥ 100×109/l).
Léčba je hrazena do potvrzení progrese onemocnění verifikované opakovaným radiologickým vyšetřením v odstupu 4–8 týdnů z důvodu odlišného mechanismu účinku imuno-onkologické terapie nebo do netolerované toxicity, maximálně do vyčerpání 35 cyklů terapie (což odpovídá době 2 let terapie).
Reference:
1. Podmínky úhrady přípravku KEYTRUDA® v indikaci metastazujícího kolorektálního karcinomu s vysokou mikrosatelitovou nestabilitou (microsatellite instability-high, MSI-H) nebo s deficitem systému opravy chybného párování bází (mismatch repair deficient, dMMR) na www.sukl.cz. Datum přístupu 13. 9. 2023.
CZ-OVC-00007 (3.0), datum přípravy: říjen 2023









